文章来源:DRF天然产物靶点发现
包裹在纳米颗粒(PNP)中的植物分子(如外泌体样纳米颗粒(ELN))存在于多种食物,并在局部和全身调节重要的肠道微生物群活性和宿主生理系统中发挥关键作用。最近的研究表明,生姜来源的ELN (GELN)可以通过调节小鼠肠道乳杆菌的色氨酸代谢来缓解结肠炎,而大蒜来源的ELN优先被肠道疣微菌门摄取,从而有助于逆转糖尿病的胰岛素抵抗。鉴于PNP已从多种不同类型的可食用植物中鉴定出来,这些PNP是否以及如何可能被某些人类肠道菌群选择性摄取,并进一步发挥调节细菌代谢产物的多样性还有待阐明。
2025年2月3日,美国路易斯维尔大学医学院Huang-Ge Zhang团队在Nat Commun在线发表题为“Plant-nanoparticles enhance anti-PD-L1 efficacy by shaping human commensal microbiota metabolites”的文章。姜来源的外泌体样纳米颗粒(GELN),GELN ally – mir159a -3p通过抑制受体细菌磷脂酶C (PLC)的表达和增加二十二碳六烯酸(DHA)的积累来增强抗pd – l1治疗黑色素瘤。

摘要
饮食已成为影响肠道菌群功能的关键因素。然而,膳食成分的复杂性使其难以预测具体结局。在本研究中,我们通过人源化小鼠模型研究了植物源纳米颗粒(PNP)在癌症免疫治疗的背景下对肠道微生物群和代谢产物的影响。具体来说,我们发现姜来源的外泌体样纳米颗粒(GELN)分别由二半乳糖基二酰基甘油(DGDG)和甘氨酸介导,被毛螺菌科(Lachnospiraceae)和乳杆菌科(Lactobacillaceae)优先摄取。我们进一步证明,GELN ally – mir159a -3p通过抑制受体细菌磷脂酶C (PLC)的表达和增加二十二碳六烯酸(DHA)的积累来增强抗pd – l1治疗黑色素瘤。循环中DHA水平的增加通过结合PD-L1启动子抑制肿瘤细胞中PD-L1的表达,并随后阻止c-myc启动的PD-L1转录。与对照组相比,补充DHA的抗pd – l1无应答患者肠道细菌的无菌雄性小鼠定植可增强抗pd – l1治疗的疗效。我们的研究结果揭示了PNP通过调节肠道细菌代谢途径对人类肿瘤免疫治疗的一个以前未知的机制影响。
1.植物源性纳米粒子(PNP)优先被特定的人类肠道细菌家族摄取
食物在通过肠道时被消化,并释放纳米大小的颗粒到肠腔。与在肠道中稳定存在的外泌体一样,发表的结果表明,植物源性外泌体样纳米颗粒(ELN)对胃肠道酸性环境、酶和胆汁提取物表现出高耐受性。可食用纳米颗粒的货物可能通过从肠腔转移到体循环的方式在局部肠道环境或远处组织中发挥生物活性。本研究主要研究了可食用植物源纳米颗粒(PNP)对人体肠道微生物群落生物学功能的影响。作为概念的证明,基于文献报道,PNP可以从生姜根,大蒜,芦荟和柠檬中分离,我们开始对从这四种植物中选择的PNP进行表征。使用差速离心法从生姜根、大蒜、芦荟和柠檬中提取PNP,并使用蔗糖梯度离心法纯化。以10万× g终速度离心分离ELN。随后,我们研究了10000 × g和100000 × g离心获得的微球中的PNP的特性,分别被称为纳米颗粒/ 10000 × g (Nano10)和外泌体样纳米颗粒/ 100000 × g (ELN)。在本研究中,包括ELNs和Nano10在内的每一种PNP都是在蔗糖梯度离心后从优势条带中纯化和收集的。通过光散射分析测量的每种PNP的产量表明,食用植物可以作为大规模生产ELN和Nano10的来源,特别是葡萄柚和生姜,它们提供了更高的ELN和Nano10的产量。柠檬的PNP产量最低。综上所述,这些数据表明食用植物中至少含有两种不同特征的PNP (Nano10, ELN)。我们从小鼠肠道微生物中获得了支持饮食在调节肠道微生物群组成和功能方面发挥作用的许多证据。然而,小鼠肠道菌群的组成与人类肠道菌群的组成不同。为了确定人类肠道细菌是否具有PNP,在知情同意的情况下,收集了15名健康受试者(25 ~ 52岁)的粪便样本。随后将细菌分离并混合在一起,以避免细菌种类的潜在变异。将人粪便细菌(hFB)等分物定植到无菌(GF) C57BL/6 J小鼠(hFB小鼠)(图1A)。
接下来,为了确定PNP是否优先被特定的肠道细菌家族摄取,我们将PKH26+标记的PNP经口灌胃给hFB小鼠,然后使用荧光激活细胞分选(FACS)对PNP/PKH26+细菌进行分选(图1A)。随后,通过16S rRNA二代测序分析了体外和体内实验中PNP/PKH26+细菌的组成(图1A, B)。通过序列优化和质量筛选,每个样本可获得102 ~ 185 k的细菌16S rRNA基因清洁标签。在相似性截断值为0.03(97%)时,一个包含36 k 16S rRNA清洁标签的子样本给出了615个可操作分类单元(OTU)。利用基本局部比对搜索工具(Basic Local Alignment Search Tool, BLAST)将16S序列与NCBI数据库进行比对,在各分类水平上可分为37个门、65个纲、115个目、192个科、352个属和其他未鉴定的类群。比较体内和体外PNPs/PKH26+细菌的组成,我们的数据表明,体外PNPs/PKH26+细菌的优势科为毛螺菌科(21.48%±5.38%),拟杆菌科(13.01%±2.40%),Coriobacteriaceae(6.99%±2.67%)和瘤胃球菌科(4.92%±2.01%)。体内实验结果为S24.7(32.43%±11.33%,LI;21.87%±14.12%,SI), Lachnospiraceae(8.25%±4.62%,LI;6.11%±4.29%,SI)和Ruminococcaceae(5.07%±2.47%,LI;4.70%±2.97%,SI),无论来自SI还是LI(图1B)。有趣的是,反刍动物对PNPs的摄取在体外和体内没有差异。综上所述,这些结果表明,PNP可以被肠道细菌摄取,除了瘤胃球菌科外,环境(体外和体内)对PNP的摄取选择性有影响。此外,我们发现摄取效率取决于PNP的类型(ELN vs . Nano10)和用于分离PNP的植物类型(图1B)。
然后,我们研究了PNP是否被密切相关的肠道细菌家族摄取。我们进行了主成分分析(PCA),以探索在选择的PNP和肠道中不同位置的PNP受体细菌组成的变化(图1C)。PCA双标图沿前两个主成分捕获了细菌组成内的大部分方差。主成分1 (PC1)解释了39.2%的方差,而主成分2 (PC2)解释了额外的20.5%的方差,累计覆盖了数据总变异的59%以上(图1C)。多变量统计PCA分析显示,根据细菌成分(即彼此接近的细菌成分),有3个聚类(图1C)。簇1包括大蒜的ELN和Nano10,姜的Nano10和芦荟的ELN,它们优先被LI中相关的相似细菌摄取。簇2包括芦荟和生姜来源的PNP,它们在SI中共享相似的受体细菌。在Cluster 3中,相似的肠道细菌在LI中优先吸收姜和柠檬来源的ELN,在SI中也优先吸收柠檬来源的ELN。为了测试细菌环境对PNP摄取的影响,我们应用主坐标分析(PCoA)在家族水平上对otu的UniFrac距离进行分析,分为体外(人类LI)和体内(小鼠LI和SI)。我们的分析表明,样品之间的距离主要由PCoA1和PCoA2决定(图1D)。统计分析表明,主成分1 (28.58%,p = 0.0001)和主成分2 (12.51%,p = 0.002)在这三种情况之间有显著差异。综上所述,我们的数据表明,膳食来源的PNP可以被人类肠道细菌选择性摄取,并且多种因素影响细菌摄取PNP,包括PNP的类型(Nano10, ELN)、用于分离PNP的植物类型和肠道微环境。
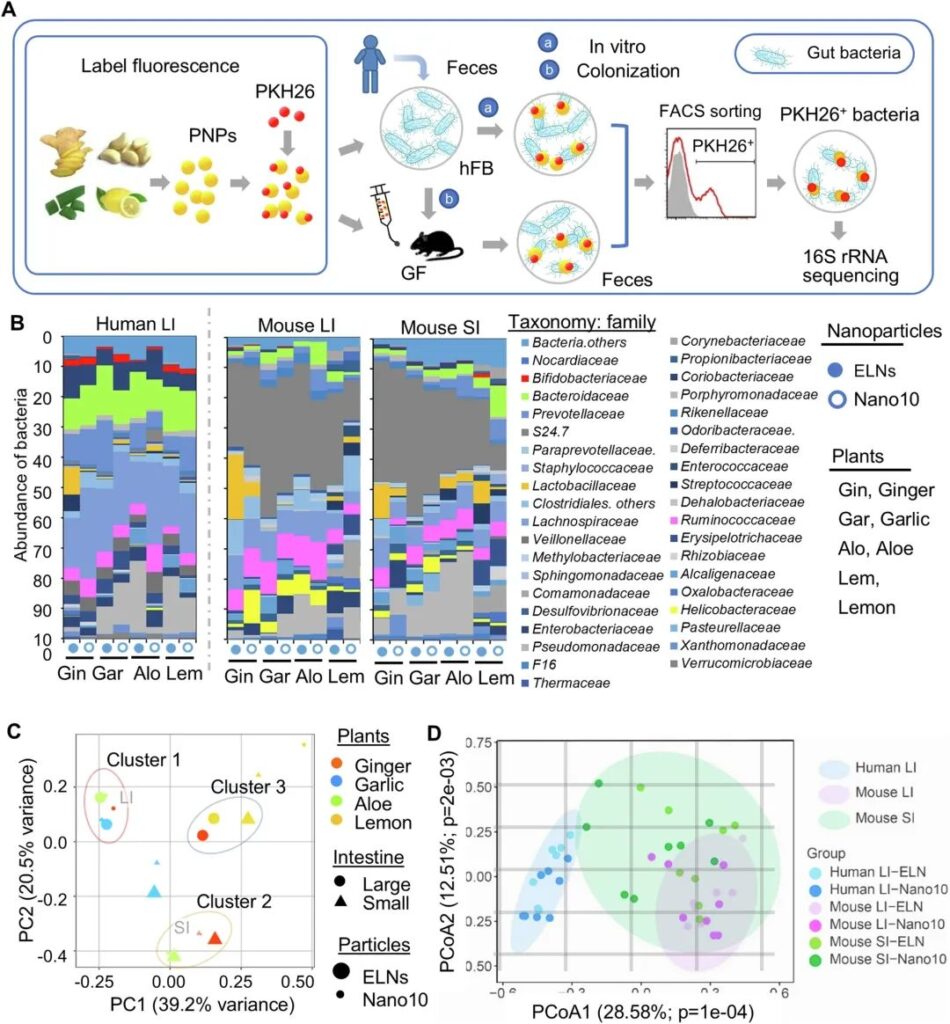
图1:人体肠道细菌对植物来源的纳米颗粒(PNP)的摄取
2.PNP脂质和氨基酸充当人类肠道细菌的“吃我”/“不要吃我”信号
饮食通过多种功能性纳米颗粒在调节肠道微生物群稳态方面发挥关键作用36,37。新兴研究和我们的数据(图1)提示,可食用PNP可被肠道细菌通过吞噬途径选择性摄取,而PNP衍生因子(如脂质和氨基酸[AA])对肠道细菌摄取纳米颗粒以调节肠道微生物群稳态产生正面或负面影响。此外,我们还阐明了PNP如何通过“吃我” / “不要吃我”信号被肠道细菌选择性摄取的分子机制。我们之前的研究表明,在小鼠肠道中,乳酸杆菌科优先被GELN摄取,这归因于GELN4中高度富集的磷脂酸(PA)。然而,一般而言,PNP脂质是否在肠道细菌的选择性摄取中发挥致病作用尚不清楚。为了确定PNP的脂质作用,我们使用三重四极杆质谱(MS)进行脂质组学分析,确定了从补充表6中列出的PNP提取的脂质和脂质组成。我们列出了从4种不同类型的植物中分离出的ELN和Nano10的组成(图2a)。Kruskal-Wallis H检验和小提琴分析表明,ELN和Nano10之间的脂质组成存在显著差异(p = 1e-09),具体来说,PA在ELN中富集,而溶磷脂酰甘油(lysoPG)和二半乳糖基二酰基甘油(DGDG)在Nano10中富集,而与PNP衍生的植物类型无关(图2B)。脂质谱的PCA图进一步揭示了大蒜PNP和柠檬PNP的整体脂质成分更相似,因为与其他类型植物的PNP相比,它们在PCA图上更接近(图2C)。相比之下,生姜、芦荟和大蒜中eln衍生的脂质的组成与它们的Nano10不同,这表明了更多的变异(图2C)。
接下来,我们确定了PNP衍生因子是否可以作为“吃我”/“不要吃我”的信号,使PNP被肠道细菌选择性摄取。我们发表的数据表明,富含pa的生姜ELN有助于乳酸杆菌的吸收。然而,虽然AELN具有高水平的PA(图2A),但乳杆菌科却只占据了很少的芦荟- eln(图1B),这表明PNP中的多个因素可能作为介导肠道细菌摄取的信号。鉴于纳米颗粒膜由多种功能因子组成,包括脂质、核酸和蛋白质/AAs,并且发现aa被细菌选择性摄取,我们假设除了脂质外,PNP膜上的aa也作为“吃我”/“不吃我”信号。为了阐明我们的假设,我们首先使用MS分析评估了PNP膜上所有20个aa的组成。我们发现,与其他AAs相比,PNP膜上的组氨酸、色氨酸、缬氨酸、亮氨酸、精氨酸和脯氨酸水平较高(图2d)。与Nano10相比,ELN膜上的AAs水平总体较高。具体来说,GELN和姜纳米10含有相对较高水平的甘氨酸,而大蒜PNP含有相对较高水平的苯丙氨酸和半胱氨酸(图2D)。采用主成分分析(PCA)探讨不同PNPs间aa成分的差异。PCA双标图(图2E)沿着前两个主成分捕获了AAs轮廓中80%以上的方差。主成分1 (PC1)解释了62.9%的方差,而主成分2 (PC2)解释了额外的20%的方差。来自柠檬、芦荟和生姜的Nano10具有共同的aa分布,因为它们在PCA图上相互靠近。只有芦荟在其ELN和Nano10上具有类似的AAs组成(图2E)。
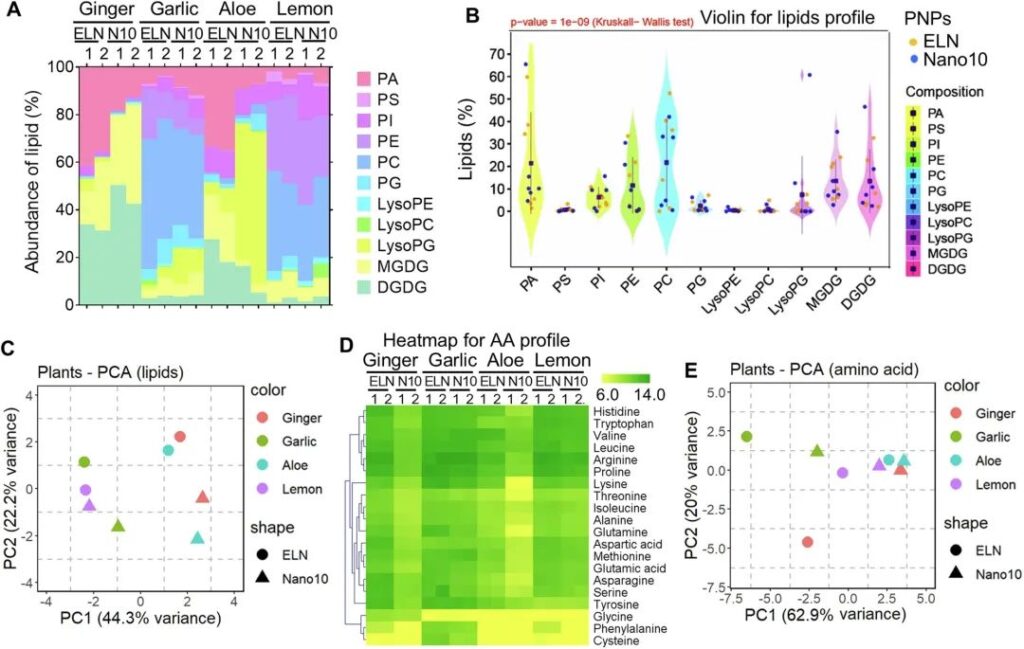
图2:PNP脂质和氨基酸组成分析
采用Spearman相关系数分析PNP中脂质和aa的相对组成与细菌摄取的相关性,探讨PNP中脂质和aa是否可以作为“吃我” / “不吃我”的信号来促进/阻止肠道细菌摄取。我们使用K-Means聚类方法42的聚类热图来显示不同肠道位置(图3A)和综合多个位置的相关系数与这些相关性的模式。红色和蓝色分别表示各肠道细菌分类科与PNP脂质/ aa含量的正相关和负相关系数。生成了火山图(图3B, C),以显示关联相对于相关系数的统计显著性。这些图作为PNP脂质(图3B)/PNP aa(图3C)和细菌丰度之间相关性的可视化表示。使用0.05的p值阈值对火山图进行分层,以突出统计学显著相关性。除了图表(图3B, C),我们还列出了基于p值排序的前10个相关性(图3B, C),例如,富含脂质单半乳糖基二酰基甘油(MGDG)的PNP作为“吃我”信号,用于乳杆菌优先摄取,而富含磷脂酰肌醇(PI)的PNP作为“不要吃我”信号,用于阻止乳杆菌摄取。乳杆菌科也优先摄取富含甘氨酸的PNP,而缬氨酸可抑制Ruminococcaceae和Lachnospirascease对PNP的摄取。
为了验证我们的相关性分析,表明PNP的脂质可以增强/抑制肠道细菌的摄取,我们用特定种类的细菌进行了摄取试验。由于特定种类的细菌可在市场上获得,我们使用了产气荚膜梭菌(C. perf) (Lachnospirascease家族的一种)和罗伊乳杆菌(L. reuteri)(乳杆菌科的一种)来测试我们的脂质相关性结果。我们随机选取了DGDG(“吃我”)和PI(“不要吃我”),因为Lachnospirascease家族优先摄取DGDG富集的GELN,而PI富集的AELN抑制乳杆菌科对AELN的摄取(图3A-C)。为了测试PNP脂质是否介导细菌的摄取,我们分别从GELN和AELN的总脂质中去除DGDG和PI 4,剩余的脂质通过超声处理重新组装成纳米大小的纳米囊泡(NV),分别称为姜NV(GNV)和芦荟NV(ANV)。FACS分析表明,受体细菌对GELN和GNV、AELN和ANV的摄取效率相似(图3D)。此外,从GNV脂质中去除DGDG显著降低了穿孔念珠菌对GNV的摄取,而添加DGDG则恢复了对GNV的摄取(图3D,左面板)。相反,PI的消耗促进了L. reuteri对ANV的摄取,而PI的添加恢复了对ANV摄取的抑制作用(图3D,右图)。
为了验证AAs对PNP是否具有促进/抑制肠道细菌摄取的作用,我们对特定种类的细菌进行了摄取实验。由于特定种类的细菌,乳杆菌科的一种罗伊乳杆菌(L. reuteri)和瘤胃球菌科的一种bromii瘤胃球菌(R. bromii)被用于检验我们的aa相关性结果。我们随机选取了甘氨酸(“吃我”)和缬氨酸(“不要吃我”),因为GELN甘氨酸促进乳杆菌科对GELN的摄取,缬氨酸抑制瘤胃球菌科对GELN的摄取(图3A-C)。为了证实我们的AAs相关性结果,我们分别用甘氨酸和缬氨酸预孵育罗伊氏乳杆菌和溴代雷氏乳杆菌。FACS分析表明,预孵育游离形式的甘氨酸抑制罗伊氏乳杆菌对GELN的摄取,而预孵育游离形式的缬氨酸促进溴代雷氏乳杆菌对GELN的摄取(图3E,左图)。用甘氨酸脱氢酶(GLDC)从GELN中去除甘氨酸可减少罗伊氏乳杆菌对GELN的摄取,而用缬氨酸脱氢酶(VDH)从GELN中去除缬氨酸可诱导溴代雷公藤对GELN的摄取(图3E,右)。这些结果也与相关分析一致,提示pnp衍生的多种因素,包括脂质和AA,可以作为“吃我”/“不要吃我”的信号,以增强/抑制人体肠道细菌的摄取。不同类型的食用植物含有多种PNP,且每种PNP都有其独特的脂质和aa组成,我们的数据表明,PNP上特定的脂质和aa谱可以通过选择性地增强/抑制肠道细菌对PNP的摄取来调节肠道菌群的稳态。
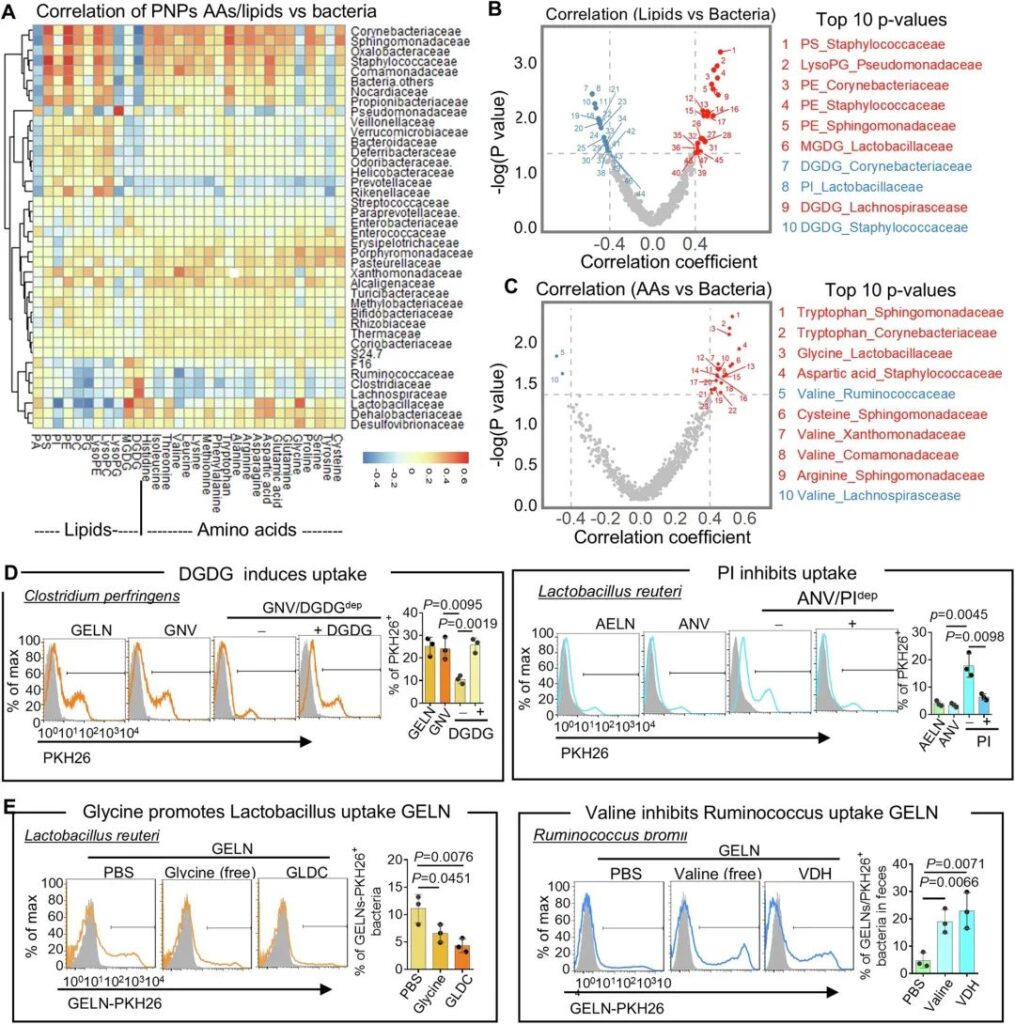
图3:肠道细菌优先摄取与PNP脂质和氨基酸组成的相关性分析
3.PNP通过改变人体肠道细菌的代谢产物来调节细胞代谢途径
为了专注于细菌代谢物并排除宿主代谢物的影响,GF小鼠的LC-MS/MS数据经过标准化处理后代表了细菌代谢物的改变。热图分析显示,PNP调节了上调和下调的肠道细菌代谢物。数据表明,来自生姜(图4A)、大蒜(图4B)、芦荟(图4C)和柠檬(图4D)的PNP对细菌代谢产物水平的影响取决于PNP的类型和肠道微环境。例如,来自同一类型植物的ELN和Nano10具有不同的作用。氨基丁酸(GABA)在eln处理的肠道细菌代谢产物中高度富集,但在nano10处理的细菌中没有。在SI中,GELN显著诱导了肠道细菌来源的不饱和脂肪酸(USF),包括二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),但在LI中没有,也没有被Nano10或其他植物来源的PNP诱导(图4A)。这一结果表明,肠道微环境影响PNP介导的对人体肠道菌群代谢产物产生的调节。

图4:通过代谢组学分析PNP对肠道细菌代谢物的影响
接下来,我们试图访问基于人类代谢的通路,这些通路可能受到PNP调节的人类肠道细菌衍生代谢物的调节。为了确定哪些代谢通路在ELN和Nano10处理后发生了改变,我们使用了KEGG代谢组学数据库。利用最新的KEGG代谢组学数据库,我们发现肠道细菌的166个差异代谢物受到ELN和Nano10的影响,并与人类代谢通路相关。代谢通路在散点图中可视化(图5A)。代谢途径的相对影响通过代谢途径中所有代谢物的变化倍数来估计,如图5A所示。更具体地说,结果表明,LI的代谢产物对ELN处理的丙氨酸,天冬氨酸,谷氨酸(AAG)途径有显著影响,而三羧酸(TCA)循环途径受到Nano10的影响,无论植物类型。有趣的是,在SI中,AAG和TCA通路都受到姜和大蒜来源的PNP的高度影响。然而,芦荟ELN和柠檬ELN分别对TCA和AAG通路没有影响,而生姜ELN在SI中显著上调USF通路。热图(图5B)表明,d -谷氨酰胺和d -谷氨酸(DGG)、精氨酸和脯氨酸(ARP)以及牛磺酸和次牛磺酸(THT)途径的活性被所有4种ELNs增强,而这些途径的活性被所有4种Nano10消除。相反,四种eln均可降低谷胱甘肽(GTA)活性,而四种Nano10均可提高GTA活性。这种变化不可能是由于用于治疗hFB小鼠的纳米粒子的量的变化,因为无论哪种类型的纳米粒子用于治疗小鼠,在ANS, ASC和GPL活性方面没有差异。此外,我们注意到,PNP处理后,生物素代谢(BIO)通路仅在小鼠的LI中发生改变,而包括BAL、AAT、MTB、USF、HIT和PTG在内的多条通路在SI中发生改变(图5B)。综上所述,这些数据表明,ELN和Nano10可能通过作用于肠道细菌释放的代谢物来调节人体代谢通路的稳态,如DGG和THT通路。
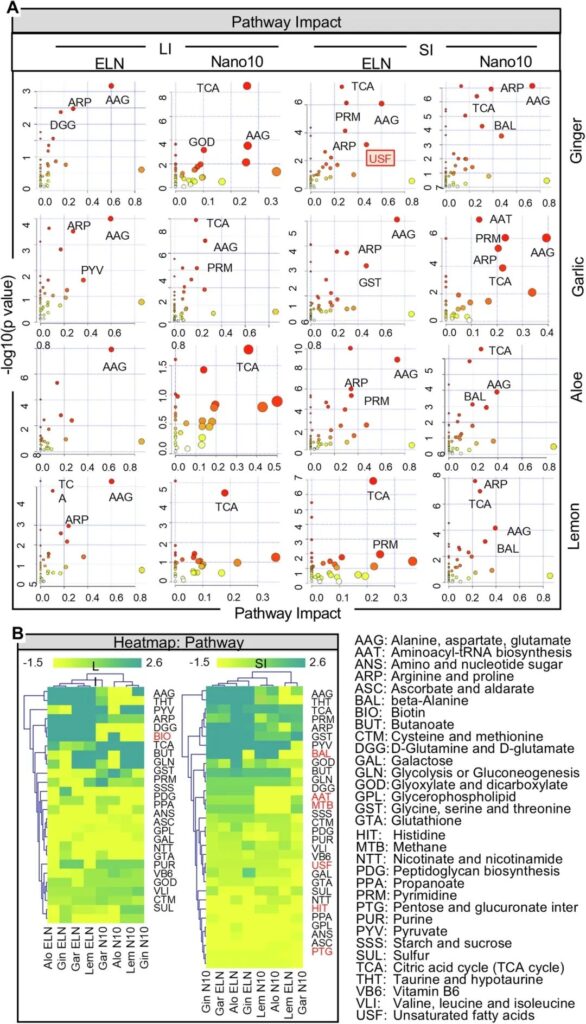
图5:pnp介导的细菌代谢产物对宿主代谢通路的影响
4.在小鼠模型中,GELN rna通过抑制黑色素瘤生长和转移来调节肠道细菌代谢活性
接下来,我们确定了通过PNP塑造肠道细菌代谢物是否有利于治疗与生态失调相关的疾病。由于患者微生物组的异质性,免疫治疗仅使一部分患者获益,因此我们利用抗黑色素瘤生长和转移的免疫检查点抑制剂PD-L1进一步检验了我们的假设,即PNP可增强靶向肠道微生物组的PNP介导的基于抗PD-L1的免疫治疗。hFB定植的雄性小鼠经口灌胃给予PNP 1个月,然后从粪便上清液中收集肠道代谢物(PNP- sup)。将B16F10黑色素瘤细胞皮下注射到hFB小鼠体内。接种7天后,我们通过腹腔(IP)注射方式将抗pd – l1 mAb (Bioxcell BE0101, 10 mg/kg,体重)以及PNP或PNP- sup给药至携带黑色素瘤B16F10的小鼠(图6A)。我们发现,生姜来源的ELN (GELN)或GELN- sup显著增强了抗pd – l1治疗对B16F10黑色素瘤生长(图6B,顶部图)和肺转移(图6B,底部图)的抑制作用。
鉴于小rna在ELN中占主导地位,我们使用了一个无序的miRNA作为对照。我们的结果表明,GNV-RNA和GNV-RNA喂养的hFB小鼠的肠道代谢物(GNV-RNA -sup)在增强抗pd – l1介导的抗B16F10黑色素瘤进展效应方面表现出相似的作用(图6C)。没有证据表明gnv – rna增强了抗pd – l1介导的抗B16F10黑色素瘤治疗,但喂食无特定病原体(SPF) hFB小鼠的gnv – rna产生的肠道代谢物恢复了gnv – rna介导的抗pd – l1治疗增强对黑色素瘤生长和肺转移的活性(图6D)。比较研究提示GNV-RNAs可改善抗pd – l1治疗对黑色素瘤肺转移的疗效(图6E),并延长hFB小鼠的生存期(图6F),但对GF小鼠无影响。综上所述,这些数据表明GNV-RNA通过肠道微生物代谢物增强PD-L1免疫治疗对抗黑色素瘤进展。
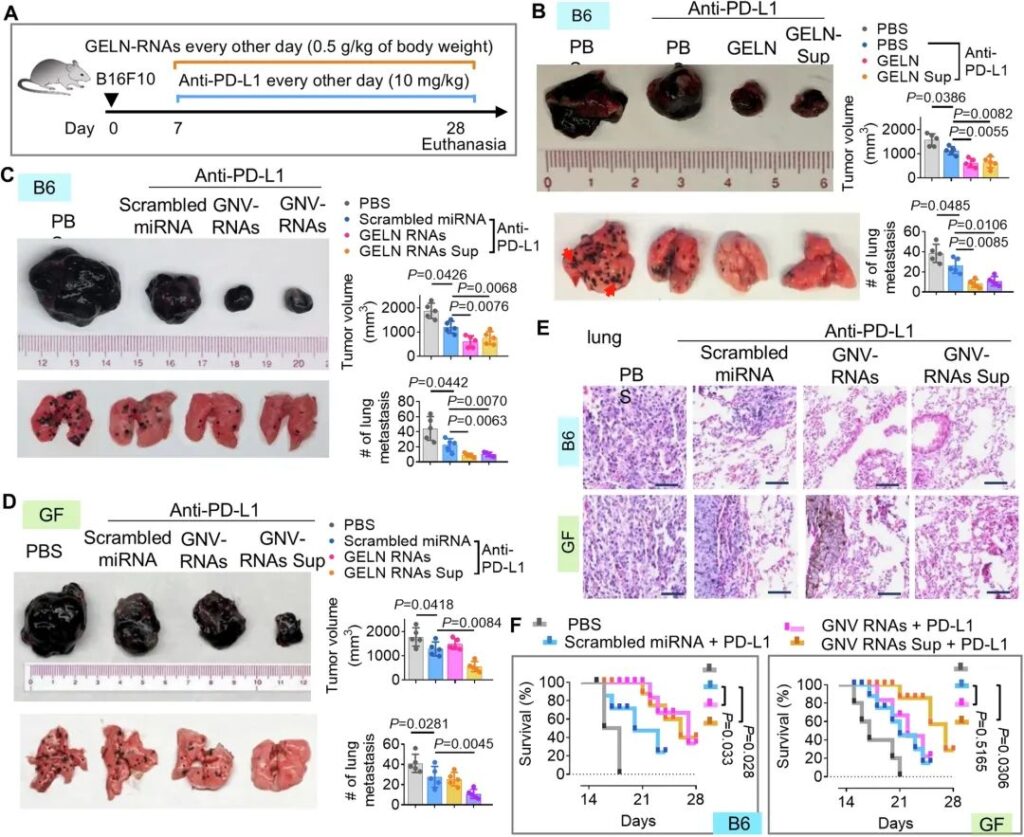
图6:姜- eln (GELN)通过肠道代谢物提高抗黑色素瘤PD-L1抗体的效果
5.GELN aly-miR159a-3p靶向细菌磷脂酶C (PLC)导致DHA蓄积
在LC-MS/MS分析中观察到在geln处理的hFB小鼠的SI中显著诱导EPA及其代谢产物DHA,而在GF小鼠中未观察到这一事实(图4A),进一步促使我们研究不饱和脂肪酸EPA和DHA是否有助于GELN-RNA增强抗pd – l1免疫治疗的分子机制。采用个体高效液相色谱法(HPLC)对LC-MS分析进行验证。正如预期的那样,EPA和DHA是由GELN特异性诱导的,而不是其他PNP。这一结果在hFB小鼠中再现,但在GF小鼠中未再现(图7A)。HPLC分析还表明,被包裹到GNV中的GELN-RNA (GNV- rna)在hFB小鼠肠道中显著诱导了DHA和EPA,但在GF小鼠肠道中没有(图7B)。相比之下,来自大蒜、芦荟和柠檬的NV-RNA混合物(NV-RNAMix)对肠道粪便和外周血中的EPA和DHA无影响(图7)。鉴于Lachnospirascease是由GELN的DGDG介导的GELN的主要靶向细菌之一(图1A)(图3D),我们利用Lachnospirascease家族中的一种c.p erf来检验我们的假设,即lachnospirasase对GELN- rna的摄取导致EPA和DHA的诱导,从而有助于增强抗pd – l1免疫治疗。用高效液相色谱法测定了穿孔C. perf培养基中DHA和EPA的含量。我们发现DHA和EPA是由GNV-RNA而不是NV-RNAMix诱导的(图7B)。接下来,我们试图确定GELN-RNA诱导DHA和EPA产生的潜在机制。利用我们之前在NCBI GEO数据库中发表的GELN- rna测序数据(accession, GSE153126),将高丰度的GELN- rna mirna序列(图7C)从NCBI RefSeq数据库(ftp://ftp.ncbi.nlm.nih.gov/genomes/refseq/bacteria/)输入细菌基因组数据库,搜索GELN mirna的潜在靶点。利用BLAST对核苷酸序列进行的比对表明,GELN miRNA aly-miR159a-3p可能通过两个7-mer长度的反向补体序列靶向磷脂酶C (PLC)(图7D),这些反向补体序列包含一个可能催化DHA生成4-oxo-DHA和4-HDHA46,47)(图7E)。为了进一步阐明GELN ally – mir159a是否抑制梭状芽孢杆菌目中PLC的表达,染色质免疫沉淀(ChIP)实验也表明,PLC DNA可以被aly-miR159a-3p C. perf(图7F,左图)和小鼠粪便(图7F,右图)拉下,但不能被aly-miR159a-3p突变体拉下。对经aly-miR159a-3p处理的c.p erf进行的qPCR(图7G)和western blot(图7H)分析表明,PLC编码基因的表达确实分别在转录和翻译水平受到抑制。对细菌培养基的HPLC分析表明,aly-miR159a处理导致DHA诱导和4-oxo-DHA减少,但对EPA无影响(图7I)。GELN aly-miR159a-3p可抑制PLC的表达。PLC可以代谢DHA为4-oxo-DHA,因此,抑制PLC的表达导致DHA在穿孔C. perf中累积(图7E)。为了进一步验证PLC对DHA代谢的作用,我们从穿孔C. perf基因组中敲除了编码PLC的基因(KO)(图7J),并使用融合pcr驱动的重叠延伸(overlap extension48,49)替换为氨苄西林耐药序列。PLC KO导致穿孔C. perf中DHA水平显著增加,4-oxo-DHA水平显著降低(图7K)。在PLC缺陷的C. perf中,aly-miR-159a-3p不再影响DHA和4-oxo-DHA水平(图7K)。
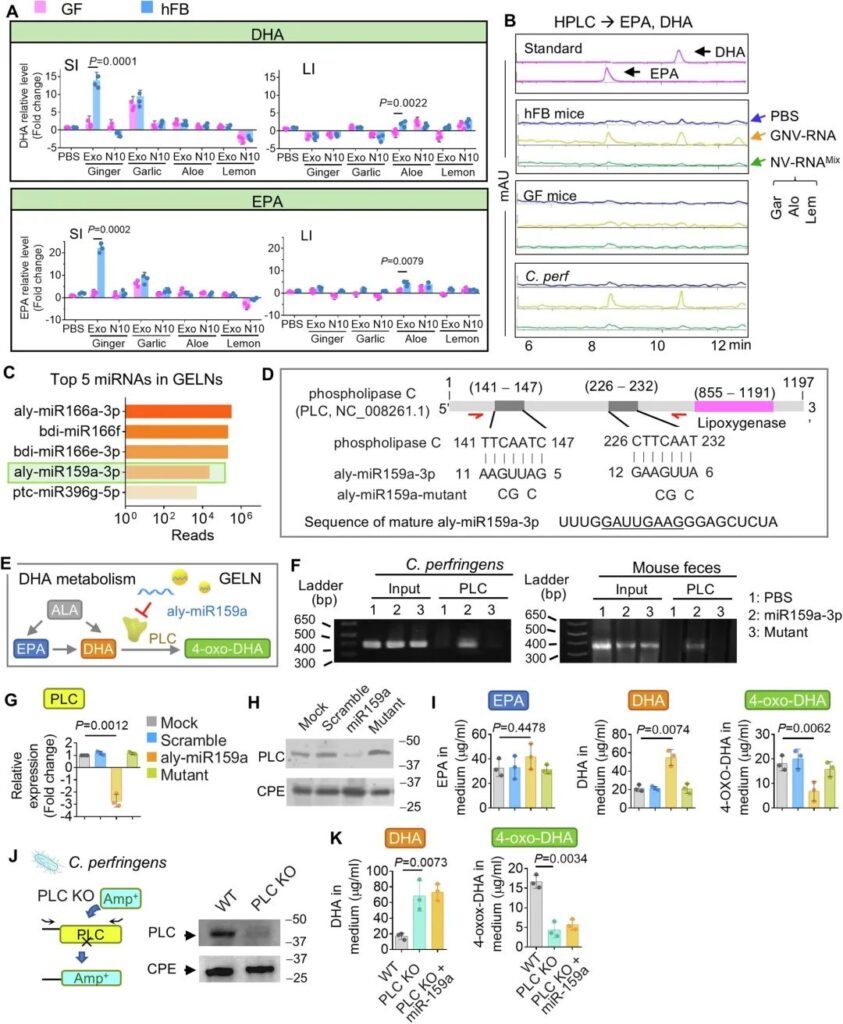
图7:富集了aly-miR159a-3p的geln通过靶向PLC调控细菌中DHA的代谢
6.DHA增强黑色素瘤抗pd – l1免疫治疗的疗效
为了进一步确定DHA是否在增强抗PD-L1治疗对抗黑色素瘤进展中发挥致病作用,B16F10黑色素瘤荷瘤小鼠接受了1个月的PD-L1 Ab(含/不含DHA或EPA)治疗。结果表明,DHA和EPA均提高了PD-L1 Ab对黑色素瘤生长(图8A,顶部图)和肺转移(图8A,底部图)的效果,并延长了小鼠的生存期(图8B)。通过qPCR(图8C)和western blot(图8D)分析肿瘤组织中PD-L1的表达,我们发现这两种代谢物分别在mRNA和蛋白水平上抑制PD-L1的表达。暴露于DHA的B16F10细胞以DHA剂量依赖性方式导致PD-L1表达降低(图8E)。
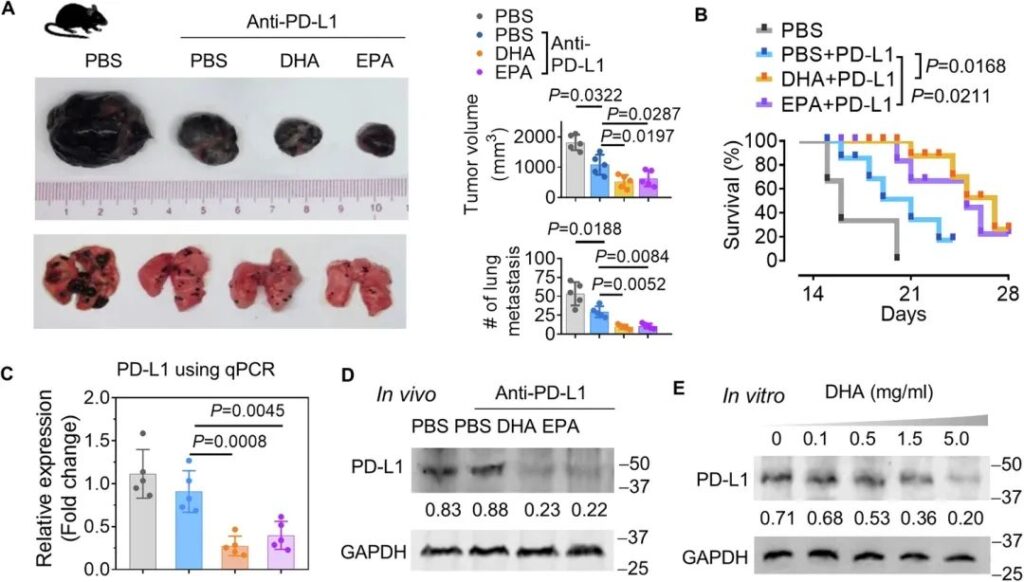
图8:DHA通过减少肿瘤细胞中PD-L1的表达来提高抗黑色素瘤的PD-L1抗体的有效性
鉴于DHA抑制PD-L1表达,并且PD-L1水平代表了抗PD-L1免疫治疗应答的潜在生物标志物,我们下一步研究临床肿瘤样本中的DHA和PD-L1水平是否与治疗应答相关。对61例福尔马林固定石蜡包埋的黑素瘤存档标本中PD-L1的表达进行分析,其中PD-L1反应组35例,PD-L1无反应组26例。行PD-L1免疫组织化学(IHC)后,对每例标本进行扫描,并采用计算机辅助方法对PD-L1表达进行评分。结果表明,与癌旁正常组织相比,黑色素瘤组织中PD-L1信号的强度(图9A,左侧IHC面板)和PD-L1+细胞的百分比(图9A,右侧条形图面板)明显增加,免疫治疗无应答患者的肿瘤组织中PD-L1的表达高于应答患者的肿瘤组织。为了进一步证实这些发现,我们采用定量方法评估了样本中PD-L1的表达。qPCR(图9B)、ELISA(图9C)和免疫印迹(图9D)的结果一致表明,与有应答的肿瘤相比,无应答的肿瘤表现出更高的PD-L1水平,无应答的肿瘤组织有更多的PD-L1 mRNA和蛋白。相反,HPLC分析表明,与邻近的非肿瘤组织相比,肿瘤中的DHA降低,并且与治疗有效的黑色素瘤患者相比,治疗无效患者肿瘤中的DHA降低(图9E)。受试者的肠道中也发现了DHA的这种减少(图9F)。PD-L1与DHA呈负相关(R2 = 0.86 ~ 0.97)。
为了评估人类肠道细菌在免疫治疗应答中的作用,我们从对PD-L1治疗有应答和无应答的受试者中分离出肠道细菌。PLC是DHA代谢成4-oxo-DHA所必需的,而4-oxo-DHA有助于癌症的发生和发展。通过qPCR测定PLC的表达,并表明来自无应答受试者的细菌中的PLC高于来自应答受试者的细菌(图9G)。然后,将应答和无应答受试者的细菌定植于GF小鼠(图9H)。我们发现,来自应答受试者的共生细菌(BacResp),而非来自无应答受试者的共生细菌(BacNon),通过抑制肿瘤生长(图9I,顶部图)和肺转移(图9I,底部图),以及延长小鼠生存期(图9J),显著改善了抗pd – l1免疫治疗。BacNon提供的DHA和BacResp同样可以提高免疫治疗的效率,这进一步表明肠道细菌的DHA通过DHA介导的抑制肿瘤细胞中PD-L1的表达在提高抗PD-L1免疫治疗中起着致病作用。考虑到PD-L1与PD-1的结合会干扰T细胞(尤其是CD8+亚群)的抗肿瘤应答和增殖,我们接下来评估了CD8+肿瘤浸润淋巴细胞中的肿瘤特异性干扰素-γ (IFNγ)水平。在FACS分析中,对CD8+PD-1+细胞进行了门控,结果表明BacResp和DHA均显著促进CD8+PD-1+ T细胞的IFNγ生成(图9K),并减少细胞凋亡(Annexin V+7-AAD -)(图9L),而BacNon无此作用。鉴于天然的和经过工程改造的PNPs通常被局部免疫细胞(如单核细胞/巨噬细胞)摄取,我们测试了GELNs是否靶向并影响肿瘤浸润免疫细胞的免疫应答。
总之,我们的数据提示,抗pd – l1无应答患者的肠道细菌表现出高水平的PLC活性。高水平的PLC活性又加速了DHA的代谢,促进肿瘤中PD-L1的表达,导致T细胞的抗肿瘤活性和生存能力受损。在无应答小鼠中,给予BacResp或DHA可增强肿瘤浸润T细胞的抗肿瘤活性,并提高抗pd – l1免疫治疗的疗效。
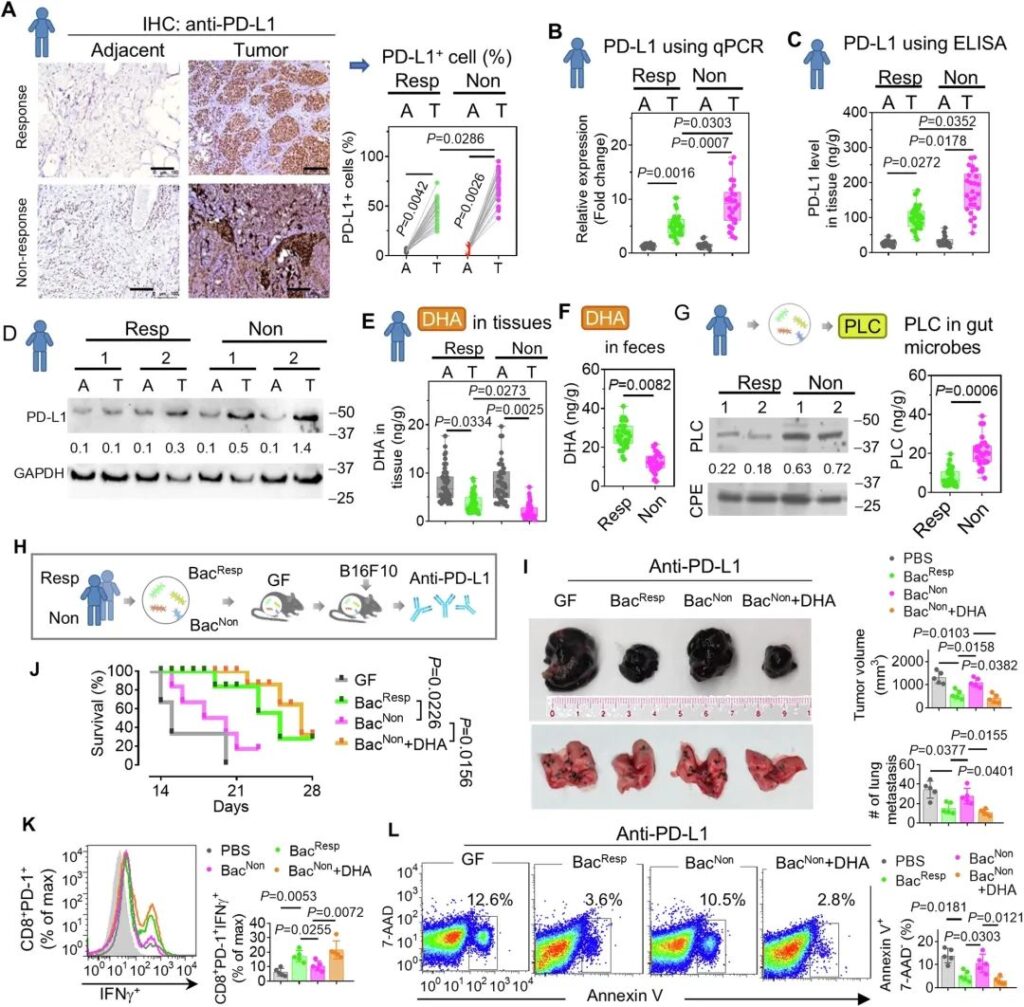
图9:在黑色素瘤患者中,PLC的诱导减轻了导致抗pd – l1免疫治疗无应答的DHA水平
7.DHA通过与PD-L1启动子区结合的表观遗传效应抑制PD-L1的表达
非变性聚丙烯酰胺凝胶电泳(PAGE)分析后,将12个DNA寡聚体(PD-L1p1到PD-L1p12,每个2µM)与DHA(10µM)孵育(图10A)。正如预期的那样,SSGS检测表明,只有寡聚PD-L1p9 (TSS上游- 380 ~ – 321)的迁移率被DHA而非EPA改变(图10B),这表明DHA而非EPA与PD-L1的启动子区结合。为了确定DHA与PD-1L启动子的准确结合位点,我们使用覆盖PD-L1p9全序列的短寡核苷酸(PD-L1p9A到PD-L1p9F,每个20 mer)和每个寡核苷酸的重叠序列来测试迁移率的变化。只有寡聚体PD-L1p9C发生了位移(图10C),这表明PD-L1p9C的序列包含一个潜在的与代谢产物DHA结合的必要序列。来自hFB定植小鼠的肠道上清,以及来自geln处理的小鼠的肠道上清,重新建立了寡核苷酸PD-L1p9C迁移率的改变(图10D)。寡核苷酸PD-L1p9C的突变消除了迁移率的改变(图10D)。为了进一步验证DHA和寡聚体PD-L1p9C的动态相互作用,我们接下来进行了表面等离子体共振(SPR)分析,这是一种检测两种不同分子相互作用的光学技术。在该技术中,生物素标记的寡聚体被固定在链亲和素传感器芯片上,而DHA通过SPR仪器的流式细胞仪进行接触。SPR检测结果表明,DHA与生物素标记的(Bio-) PD-L1p9C结合,但不与突变的(Bio-) PD-L1p9C (PD-L1p9C- mut)结合(图10E)。这一结果与SSGS检测结果一致。为了进一步确定DHA与PD-L1启动子的结合是否会改变PD-L1启动子的活性,我们将小鼠PD-L1启动子序列引入Gaussia荧光素酶报告基因(pEZX-mPDL1, GeneCopoeia)。以DHA结合序列修饰的突变体(pEZX-mPDL1-Mut)作为对照。荧光素酶实验表明,DHA抑制转染pEZX-mPDL1的细胞的荧光素酶活性,但不抑制突变体(图10F)。为了进一步揭示DHA结合所需的特定DNA基序,我们合成了20 mer长度的含有潜在DHA结合基序的DNA寡核苷酸。在20个寡核苷酸中,每个寡核苷酸含有1个突变碱基。我们假设,如果必需碱基被取代,寡核苷酸的DHA结合活性将降低。正如预期的那样,SSGS分析提示,PD-L1 TSS上游的- 341 ~ – 358序列AGCCT……ATCAGC是DHA结合所必需的(图10G)。多重序列比对表明,这一PD-L1结合基序在人类和小鼠中是保守的序列,两者在PD-L1基因的启动子区都共享这一共有序列(图10H)。
更有趣的是,使用PROMO 3.0对转录因子结合位点的预测(http://alggen.lsi.upc.edu)表明,小鼠和人类PD-L1启动子在DHA结合位点附近都有一个c-myc结合基序(CCAGGTG)(图10H)。使用含有小鼠(pEZX-mPDL1)和人(pEZX-hPDL1) PD-L1启动子序列的报告基因进行的荧光素酶实验表明,在转染pEZX-mPDL1和pEZX-hPDL1的细胞中,c-myc缺陷取消了dha介导的荧光素酶活性抑制(图10I)。重组c-myc与pEZX-mPDL1或pEZX-hPDL1共转染可恢复DHA抑制活性。这些数据表明,细菌代谢物DHA通过抑制c-myc介导的肿瘤细胞PD-L1表达诱导,增强抗PD-L1免疫治疗的疗效。
为了进一步确定DHA和PD-L1启动子之间的分子结合位点和结构,我们使用Mfold测试了含有DHA靶向序列的小鼠和人PD-L1启动子序列的二级结构(图10H),然后使用HDOCK服务器(http://hdock.phys.hust.edu.cn/)分析对接。利用UCSF Chimera58分析的潜在分子相互作用模式表明,DHA和PD-L1启动子之间通过G-4 (m)和G-11 (h)位置的氢键相互作用,发生的对接分数为-39.98,配体rmsd (Å)为19.83(图10J)。对SPR的进一步分析表明,DHA抑制c-myc作为转录因子募集到PD-L1的启动子(图10K)。试管实验进一步证实了DHA与PD-L1启动子区相互作用的结果。B16F10黑色素瘤细胞用肠道上清液和生物素标记(Bio)-PD-L1p9C (Bio- wt)或Bio- s100p1 – g突变体(Bio- mutant)处理6小时,并用链霉亲和素珠从细胞裂解液中拉出复合物,用于定量分析代谢物。LC-MS结果表明DHA被PD-L1p9C募集到复合物中,而不是被突变体募集(图10L)。
综上所述,这些数据表明DHA通过表观遗传效应抑制小鼠和人PD-L1在黑色素瘤细胞中的表达。肠道DHA水平和PD-L1表达呈负相关进一步证明了DHA增强抗PD-L1治疗的生物学效应。
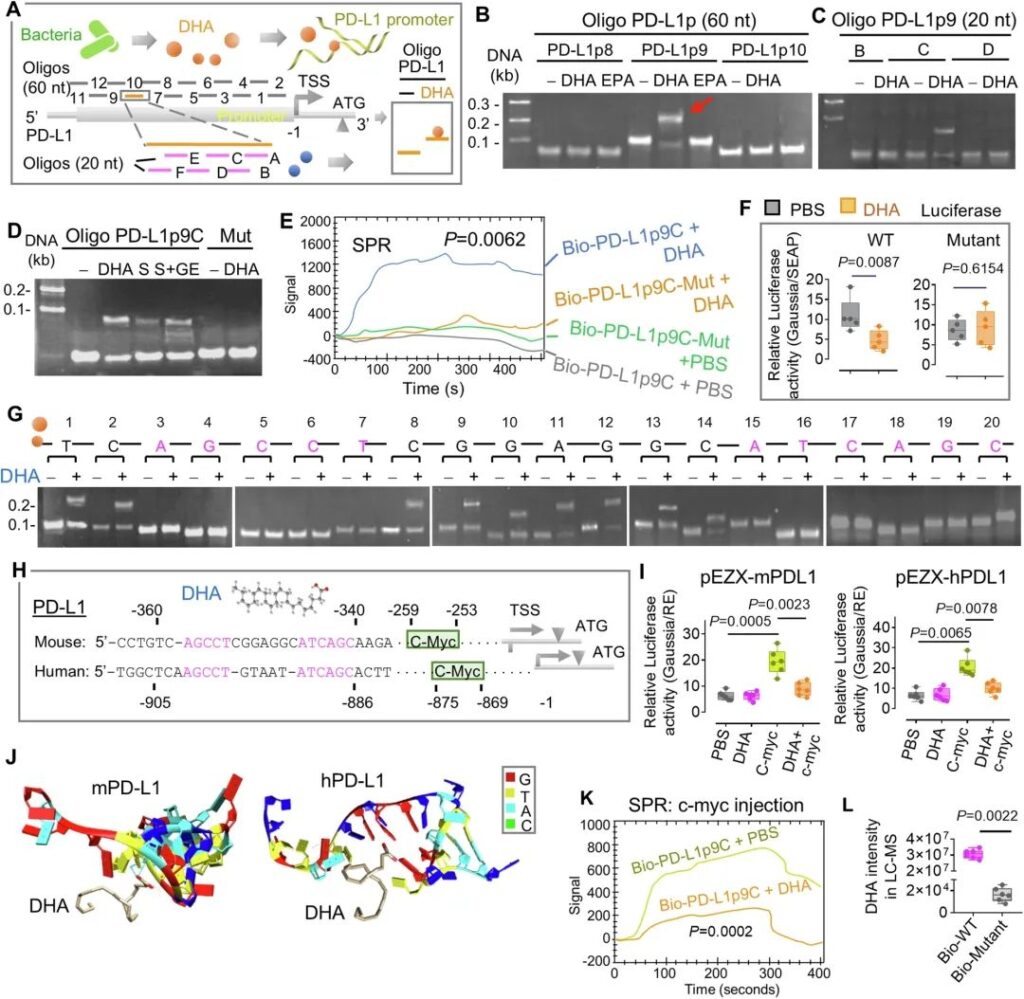
图10:DHA干扰转录因子c-myc对PD-L1启动子的访问
结论
姜来源的外泌体样纳米颗粒GELN可以通过靶向人类肠道共生菌群的不饱和脂肪酸代谢通路来增强黑色素瘤抗pd – l1治疗的疗效。这一创新策略通过将天然化合物与先进的免疫疗法相结合,为提高癌症治疗效果开辟了新的途径。
Teng Y, Luo C, Qiu X, Mu J, Sriwastva MK, Xu Q, Liu M, Hu X, Xu F, Zhang L, Park JW, Hwang JY, Kong M, Liu Z, Zhang X, Xu R, Yan J, Merchant ML, McClain CJ, Zhang HG. Plant-nanoparticles enhance anti-PD-L1 efficacy by shaping human commensal microbiota metabolites. Nat Commun. 2025 Feb 3;16(1):1295. doi: 10.1038/s41467-025-56498-2.
