文章来源:摩熵医药
1.4.1本周全球创新药研发概览
(1)本周全球TOP10创新药研发进展
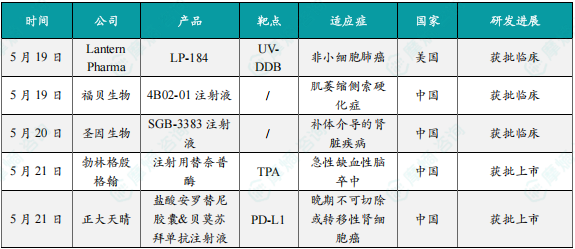
1.Lantern Pharma抗癌新药LP-184在美国获批临床
5月19日,Lantern Pharma公司宣布,FDA已批准其抗癌新药LP-184的IND申请。LP-184将与免疫检查点抑制剂联用,针对携带KEAP1和/或STK11突变和PD-L1低表达的非小细胞肺癌(NSCLC)患者开展1b/2期临床试验。LP-184是一种新型“合成致死”小分子药物,其作用机制是在前列腺素还原酶1(PTGR1)的激活下诱导DNA双链断裂。PTGR1在KEAP1突变型肿瘤中显著过表达。临床前研究表明,LP-184对NSCLC细胞系的杀伤力与PTGR1的表达水平呈正相关。该公司专有的RADR平台驱动的计算机分析和临床前研究表明,LP-184对DNA损伤修复(DDR)缺陷型癌症特别有效,包括携带KEAP1和STK11突变的NSCLC。此外,PTGR1会在肿瘤细胞内将LP-184由前药转化为具有生物活性的细胞毒性物质,而正常组织由于PTGR1表达水平低,基本不受影响,这使得LP-184有望在具有强效抗肿瘤活性的同时降低全身毒性。值得注意的是,LP-184的作用机制不受TP53突变状态影响,该突变是导致当前多种疗法产生耐药性的常见共突变因素。
2.福贝生物1类新药4B02-01注射液在中国获批临床,针对渐冻症
5月19日,福贝生物宣布,其自主开发的具有全新作用机制的1类新药4B02-01注射液获得中国国家药品监督管理局药品审评中心(CDE)临床试验默示许可,拟开展治疗肌萎缩侧索硬化症(俗称渐冻症,简称ALS)的临床试验。ALS是一种危及生命的退行性运动神经元病,患者出现上、下运动神经元受损,运动功能持续衰退,肌肉萎缩无力,最终导致呼吸衰竭而死亡。从首个临床症状发生到无法说话、吞咽、呼吸,患者的生存期仅为2-5年,是WHO认定的世界五大绝症之一。4B02-01作为福贝生物第三款进入临床阶段的ALS治疗新药,将凭借其独特的TrkB功能激活机制,与已进入临床的CSF1R抑制剂4B02-01(抑制神经炎症)和AI辅助开发的4B02-01(调节神经传导)形成协同互补,为攻克这一医学难题提供更多可能性。
3.圣因生物在研药物SGB-3383注射液在中国获批临床
5月20日,圣因生物(SanegeneBio)宣布,其自主研发的靶向CFB的小核酸(siRNA)药物SGB-3383注射液临床试验申请已获得中国国家药品监督管理局药品审评中心(CDE)临床试验默示许可,拟用于治疗补体介导的肾脏疾病(包括IgA肾病、C3肾小球病、免疫复合物介导的膜增生性肾小球肾炎、非典型溶血尿毒综合征等)。SGB-3383是一款靶向CFB的RNAi疗法,通过RNAi抑制肝脏中CFB的表达,从而治疗补体介导的肾脏疾病。临床前试验数据表明,SGB-3383能显著且持久地降低肝脏和血液中CFB的水平,同时具有良好的安全性和耐受性。
4.勃林格殷格翰溶栓治疗药物注射用替奈普酶在中国获批上市
5月21日,中国国家药品监督管理局(NMPA)官网公示,勃林格殷格翰(Boehringer Ingelheim)申报的注射用替奈普酶的上市申请已获得批准。替奈普酶是一款新型溶栓药物,本次获批的适应症为治疗4.5小时内急性缺血性卒中。据文献报道,急性缺血性卒中(AIS)是中国成年人群致死、致残的首位病因,占所有卒中的70%左右。对于AIS患者,症状发作后4.5小时内进行静脉溶栓治疗被视为首选疗法,可帮助患者实现早期血管再通,迅速恢复脑血流,从而降低急性缺血性卒中的致残率。替奈普酶是勃林格殷格翰公司经典溶栓产品阿替普酶的变构体,阿替普酶是静脉溶栓中的标准药物治疗方法,替奈普酶与阿替普酶仅有3个氨基酸存在差异,其作用机制已得到证实。相比于阿替普酶,替奈普酶给药方便,可在5~10s内单次静脉推注给药,无需使用静脉输液泵,有利于治疗。
5.正大天晴PD-L1联合疗法新适应症获批,针对晚期不可切除或转移性肾细胞癌
5月21日,中国国家药监局(NMPA)官网公示,正大天晴盐酸安罗替尼胶囊和贝莫苏拜单抗注射液的新适应症上市申请已获得批准。根据公开资料,本次获批的是二者的联合疗法,用于一线治疗晚期不可切除或转移性肾细胞癌(RCC)。肾癌是泌尿系统最常见的恶性肿瘤之一,RCC占全部肾癌病例的80%~90%。据文献数据,约三分之一的肾癌患者在初诊时已发生肿瘤远处转移,而局限性患者接受肾切除术后仍有20%-50%出现肿瘤远处转移。贝莫苏拜单抗是正大天晴研发的全新序列的创新抗PD-L1人源化单克隆抗体,该药于2024年5月在中国首次获批上市,适应症为联合安罗替尼胶囊和依托泊苷及卡铂一线治疗广泛期小细胞肺癌(ES-SCLC);于2024年11月再次获NMPA批准,联合盐酸安罗替尼胶囊治疗特定的复发性或转移性子宫内膜癌。安罗替尼是正大天晴开发的新型小分子多靶点酪氨酸激酶抑制剂,于2018年在中国首次获批上市,目前已经在中国获批多个肿瘤适应症,包括非小细胞肺癌、小细胞肺癌、软组织肉瘤、甲状腺髓样癌、分化型甲状腺癌等。
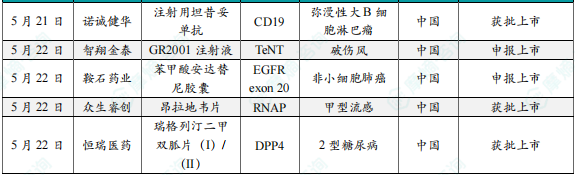
6.诺诚健华CD19单抗坦昔妥单抗在中国获批上市
5月21日,中国国家药监局(NMPA)官网公示,诺诚健华申报的坦昔妥单抗(tafasitamab)的新药上市申请已获批准。坦昔妥单抗是一款靶向CD19的Fc结构域优化的人源化单克隆抗体,根据NMPA药品审评中心(CDE)此前优先审评公示,该药本次获批的适应症为联合来那度胺治疗不适合自体干细胞移植条件的复发/难治弥漫性大B细胞淋巴瘤(DLBCL)成人患者。坦昔妥单抗是一款靶向CD19的Fc结构域优化的人源化单克隆抗体。坦昔妥单抗包含独有的工程化Fc结构域,因此显著强化了抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),通过细胞凋亡和免疫效应机制介导B细胞肿瘤的裂解。
7.智翔金泰1类新药GR2001注射液在中国申报上市
5月22日,中国国家药监局药品审评中心(CDE)官网公示,智翔金泰申报的1类新药GR2001注射液上市申请获得受理。GR2001是一款靶向破伤风毒素(TeNT)的单克隆抗体,能特异性结合破伤风神经毒素,有效阻断其进入神经元细胞,从而预防破伤风。破伤风是一种由破伤风梭状芽孢杆菌通过伤口侵入人体引起的急性特异性感染。当破伤风梭菌经皮肤、粘膜破口侵入人体后,可以在厌氧环境中繁殖并产生外毒素,引发破伤风症状,包括肌肉痉挛、强烈的疼痛、呼吸困难等,严重者可能导致死亡。GR2001能特异性结合破伤风神经毒素重链C端,阻断其进入神经元细胞,预防破伤风。从作用机制上来说,单抗类产品具有安全性和耐受性良好,免疫原性低,可控性和可及性更强等优势。
8.鞍石药业小分子肺癌新药安达替尼在中国申报上市
5月22日,中国国家药监局药品审评中心(CDE)官网公示,鞍石药业申报的1类新药苯甲酸安达替尼胶囊上市申请获得受理。公开资料显示,安达替尼是一款新型小分子酪氨酸激酶不可逆抑制剂(EGFR-TKI)。该药的本次上市申请此前已经被CDE纳入优先审评,适应症为:用于治疗既往经含铂化疗和/或PD-1/PD-L1免疫治疗时或治疗后出现疾病进展,或不耐受,并且经检测确认存在表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)的患者。安达替尼(PLB1004)胶囊是一款EGFR小分子抑制剂,具有高选择性,可以透过血脑屏障。临床前研究显示其能够有效且不可逆地靶向作用于EGFR 20号外显子插入突变(EGFR 20 ins)。此外,该分子还可有效地靶向作用于Del19、L858R和T790M等经典的EGFR突变,具有较高的选择性。
9.众生睿创1类新药昂拉地韦片获批上市,用于治疗甲流
5月22日,中国国家药监局(NMPA)官网公示,众生药业控股子公司众生睿创申报的1类创新药昂拉地韦片上市申请已获得批准,适用于成人单纯性甲型流感患者的治疗。昂拉地韦片是一款流感RNA聚合酶PB2蛋白抑制剂,可通过作为“帽子”结构的类似物与PB2亚基结合,进而抑制RNA聚合酶复合物的复制功能正常启动,从而抑制病毒生命周期基因组的转录和复制等多种功能,达到抗甲型流感病毒的作用。临床前研究结果表明,昂拉地韦对多种甲型流感病毒的抑制能力优于核酸内切酶抑制剂以及神经氨酸酶抑制剂,并且对于神经氨酸酶抑制剂耐药的病毒株、核酸内切酶抑制剂耐药的病毒株和高致病性禽流感病毒株均具有很强的抑制作用。
10.恒瑞医药1类降糖新药瑞格列汀二甲双胍片(I)/(II)获批上市
5月22日,中国国家药品监督管理局(NMPA)官网宣布,批准恒瑞医药申报的1类创新药瑞格列汀二甲双胍片(I)/(II),该药配合饮食控制和运动,适用于适合接受磷酸瑞格列汀和盐酸二甲双胍治疗的2型糖尿病成人患者改善血糖控制。公开资料显示,这是恒瑞医药开发的二肽基肽酶Ⅳ(DPP-4)抑制剂磷酸瑞格列汀与二甲双胍组成的固定剂量复方制剂。目前,二甲双胍已被许多临床实践指南推荐为2型糖尿病患者的首选治疗药物,但许多患者会对二甲双胍产生耐受,因此不少公司正在开发合适的联合用药产品,以期达到更好的临床疗效。此次恒瑞医药获批上市的瑞格列汀二甲双胍片(HRX0701片),正是由瑞格列汀与二甲双胍组成的一款复方制剂。该产品通过两种不同作用机制达到降血糖作用,同时固定剂量复方制剂(FDC)可以减少药物漏服、提高治疗依存性。
(2)本周全球TOP10积极/失败临床结果
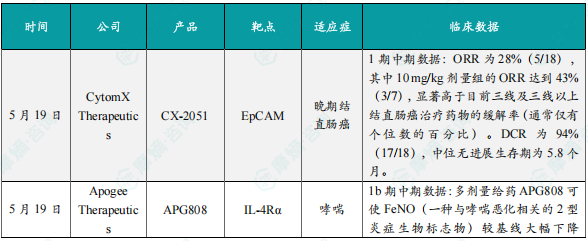
1.CytomX Therapeutics公布CX-2051 1期临床试验中期积极数据
5月19日,CytomX Therapeutics公布了其ADC疗法CX-2051在晚期结直肠癌(CRC)中的积极1期中期数据。CX-2051是一种条件激活型ADC,其使用的细胞毒性有效载荷是喜树碱的衍生物。喜树碱是一种拓扑异构酶-1抑制剂,这类药物已在ADC领域针对多个靶点显示出强大的临床抗癌活性。CX-2051已在包括结直肠癌在内的多个临床前模型中显示出强大的临床前活性和耐受性。截至2025年4月7日的数据,ORR为28%(5/18),其中10 mg/kg剂量组的ORR达到43%(3/7),显著高于目前三线及三线以上结直肠癌治疗药物的缓解率(通常仅有个位数的百分比)。DCR为94%(17/18),中位无进展生存期为5.8个月。截至数据截止时,18名患者中有10名仍在接受治疗。安全性方面,CX-2051的耐受性良好,未出现剂量限制性毒性(DLT),大多数治疗相关不良事件为1级或2级。
2.Apogee Therapeutics公布APG808 1b期临床试验中期积极数据
5月19日,Apogee Therapeutics公司公布了其候选单抗APG808用于治疗轻度至中度哮喘患者的1b期临床试验的积极中期数据。APG808是一种新型、皮下注射、半衰期延长的IL-4Rα靶向单抗,具有用于治疗哮喘、慢性阻塞性肺病(COPD)及其他炎症与免疫学适应症的潜力。IL-4Rα是一个已在八种2型过敏性疾病中得到临床验证的靶点。在1期临床试验中,APG808的药代动力学(PK)特征有望支持每2-3个月一次的维持治疗给药方案。此次公布的结果显示,多剂量给药APG808可使FeNO(一种与哮喘恶化相关的2型炎症生物标志物)较基线大幅下降53%,并在12周时仍维持约50%的抑制水平,显示出对哮喘的持续控制能力。APG808的优化配方和潜在“best-in-class”的PK特征,结合在12周内对FeNO的强效且持续的抑制作用,有望支持其实现每两个月或更长时间一次的给药方案,相较于目前每两周一次的标准治疗具有优势。此外,APG808整体耐受性良好,安全性特征与已有的抗IL-4Rα疗法一致。
3.Corvus Pharmaceuticals公布soquelitinib 1期临床队列1-3试验数据
5月19日,Corvus Pharmaceuticals公司公布了其小分子白细胞介素-2诱导的T细胞激酶(ITK)抑制剂soquelitinib用于治疗中度至重度特应性皮炎的1期临床试验数据。ITK是一种主要表达于T细胞中的酶,在T细胞和自然杀伤(NK)细胞的免疫功能中起重要作用。通过抑制ITK,soquelitinib有望抑制自身免疫和炎症反应。此次公布的结果显示,所有3个队列中,soquelitinib治疗组在具有临床意义的终点湿疹面积和严重度指数较基线减少75%(EASI 75)和研究者总体评估(IGA)评分为0/1(皮肤症状清除或几乎清除)上,均显示出相较于安慰剂的显著疗效。与队列1和队列2(100 mg每天两次和200 mg每天一次,每日总剂量200 mg)相比,队列3(200 mg每天两次,每日总剂量400 mg)的缓解更早且更深。安全性方面,soquelitinib的耐受性良好,在所有队列中均未观察到DLT,也未出现具有临床意义的实验室指标异常。此外,所有队列中均未发生中断给药的情况。
4.Enliven Therapeutics公布ELVN-001 1期临床试验新数据
5月19日,Enliven Therapeutics公司公布其小分子激酶抑制剂ELVN-001治疗慢性粒细胞白血病(CML)患者的1期临床试验的新数据。ELVN-001是一种强效、高选择性、潜在“best-in-class”的小分子激酶抑制剂,专门针对CML患者的致癌驱动因子BCR-ABL融合蛋白。ELVN-001还具有针对耐药性最强的BCR-ABL1耐药突变体T315I和其他已知耐药突变体的活性。截至2025年1月21日的数据,在36例可评估的患者中,44%(16/36)在24周时达到主要分子学缓解(MMR),其中最后一线治疗时对酪氨酸激酶抑制剂(TKI)耐药的患者中有40%(10/25)达到了MMR,曾接受asciminib或ponatinib治疗的患者中也有36%(9/25)达到MMR,包括1例携带已知asciminib耐药突变的患者。所有达到或维持MMR的患者在数据截止时仍保持缓解。在该临床试验中所纳入的患者群体此前接受过大量治疗的情况下,ELVN-001与已获批的针对BCR-ABL融合蛋白的TKI在1期试验中所观察到的MMR相比,结果依然更好。安全性方面,ELVN-001在所有剂量组中仍表现出良好的耐受性,与其选择性激酶谱一致。
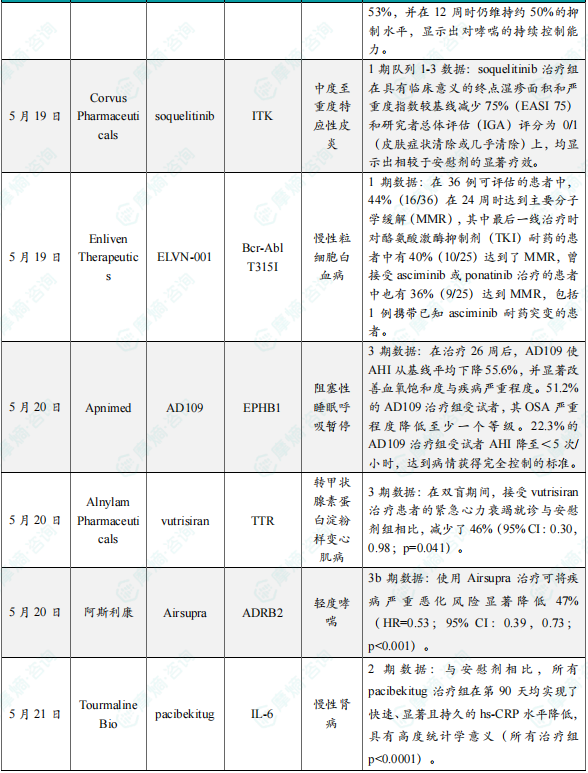
5. Apnimed公布AD109 3期临床试验积极结果
5月20日,Apnimed公司宣布,其潜在“first-in-class”口服候选药物AD109在关键性3期临床试验SynAIRgy中获得积极结果。AD109是一种潜在“first-in-class”抗睡眠呼吸暂停神经肌肉调节剂。它是一种由选择性去甲肾上腺素再摄取抑制剂托莫西汀(atomoxetine)与抗毒蕈碱药物aroxybutynin构成的组合配方。AD109靶向OSA关键的神经通路,通过激活上呼吸道扩张肌,使得患者在睡眠时仍可维持呼吸道的畅通。该试验评估了AD109在轻度、中度和重度阻塞性睡眠呼吸暂停(OSA)成人患者中(涵盖所有体重类别)的疗效与安全性。SynAIRgy试验达到主要终点:与安慰剂相比,AD109在治疗26周后显著改善呼吸暂停低通气指数(AHI),平均变化具有统计学显著性(p=0.001)。Apnimed公司今日宣布,其潜在“first-in-class”口服候选药物AD109在关键性3期临床试验SynAIRgy中获得积极结果。该试验评估了AD109在轻度、中度和重度阻塞性睡眠呼吸暂停(OSA)成人患者中(涵盖所有体重类别)的疗效与安全性。SynAIRgy试验达到主要终点:与安慰剂相比,AD109在治疗26周后显著改善呼吸暂停低通气指数(AHI),平均变化具有统计学显著性(p=0.001)。
6. Alnylam Pharmaceuticals公布vutrisiran 3期临床试验数据
5月20日,Alnylam Pharmaceuticals公布了3期临床试验HELIOS-B的最新分析结果,该研究评估了RNAi疗法vutrisiran治疗伴有心肌病的转甲状腺素蛋白淀粉样变性患者(ATTR-CM)的效果。结果显示,vutrisiran能够快速降低转甲状腺素蛋白水平,减少关键心血管事件,如因心血管事件住院和因心力衰竭(HF)住院。此外,在双盲期间,接受vutrisiran治疗患者的紧急心力衰竭就诊与安慰剂组相比,减少了46%(95% CI:0.30,0.98;p=0.041)。这些心血管事件通常是全因死亡(ACM)的前兆,也是疾病进展的关键指标。
重要的是,2024年11月的数据分析(包括长达42个月的随访)进一步验证了HELIOS-B主要分析中vutrisiran对ACM的影响,并表明vutrisiran能够降低心血管死亡风险。在42个月内,患者的全因死亡风险降低了36%(95% CI:0.46,0.88;p=0.007),心血管死亡风险降低了33%(95% CI:0.47,0.96;p=0.038)。
7.阿斯利康公布Airsupra 3b期临床试验积极结果
5月20日,阿斯利康(AstraZeneca)宣布,3b期临床试验BATURA的完整结果显示,其“first-in-class”哮喘疗法Airsupra(沙丁胺醇/布地奈德),在所有主要和次要终点上均较沙丁胺醇组实现具有统计学显著性和临床意义的改善。该试验比较了按需使用Airsupra与按需使用沙丁胺醇在轻度哮喘患者中的疗效,试验结果显示,使用Airsupra治疗可将疾病严重恶化风险显著降低47%(HR=0.53;95% CI:0.39,0.73;p<0.001)。在一项关键性次要终点中,12岁及以上的青少年和成人在使用Airsupra治疗期间,系统性糖皮质激素(SCS)暴露总量较沙丁胺醇组降低63%(p<0.001),从而减少了累积使用SCS带来的已知风险。Airsupra是一种“first-in-class”短效β2受体激动剂(SABA)和吸入型糖皮质激素(ICS)组合,可按需使用。该药物为固定剂量吸入制剂,含有沙丁胺醇与布地奈德,采用阿斯利康的Aerosphere加压定量吸入器(pMDI)递送技术开发而成。
8. Tourmaline Bio公司公布在研单抗pacibekitug 2期临床试验积极结果
5月21日,Tourmaline Bio公司宣布,其进行中的2期TRANQUILITY临床试验取得积极的顶线结果。该试验评估其在研单抗pacibekitug以每季一次或每月一次皮下注射的方式,用于治疗高敏C反应蛋白(hs-CRP)水平升高的3级或4级慢性肾病(CKD)患者的效果。研究显示,与安慰剂相比,所有pacibekitug治疗组在第90天均实现了快速、显著且持久的hs-CRP水平降低,具有高度统计学意义(所有治疗组p<0.0001)。其中,每季一次50 mg给药组的hs-CRP平均降低幅度超过85%。Pacibekitug是一种作用持久的全人源抗IL-6单克隆抗体,为潜在“best-in-class”疗法,其特点包括天然长半衰期、低免疫原性和对IL-6的高结合亲和力。
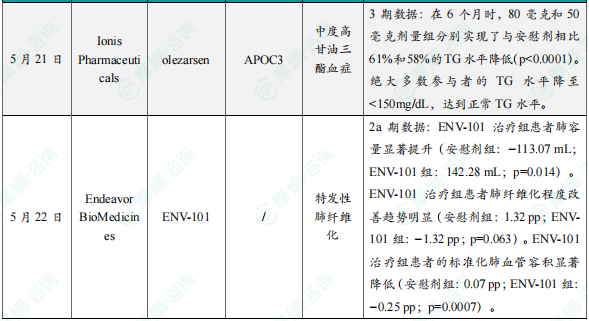
9.Ionis Pharmaceuticals公布olezarsen 3期临床试验积极结果
5月21日,Ionis Pharmaceuticals宣布,其开发的“first-in-class”反义寡核苷酸(ASO)疗法Tryngolza(olezarsen)在Essence临床3期研究中取得积极的顶线结果。该研究针对伴有或不伴有动脉粥样硬化性心血管疾病(ASCVD)风险的中度高甘油三酯(TG)血症患者。结果显示,olezarsen在治疗6个月后显著降低了患者的甘油三酯水平,达到主要终点,且在所有关键次要终点上也取得统计学显著改善。Essence是一项全球、多中心、随机、双盲、安慰剂对照3期研究。参与者被随机分配接受每4周皮下注射一次50 mg(n=276)或80 mg(n=832)olezarsen或安慰剂(n=369)治疗,持续12个月。分析显示,试验达到其主要终点,在6个月时,80毫克和50毫克剂量组分别实现了与安慰剂相比61%和58%的TG水平降低(p<0.0001)。Olezarsen还达到了研究中的所有关键次要终点,绝大多数参与者的TG水平降至<150mg/dL,达到正常TG水平。
10. Endeavor BioMedicines公布在研药物ENV-101 2a期临床试验分析结果
5月22日,Endeavor BioMedicines公布其在研主打疗法ENV-101(taladegib)完成的2a期临床试验的事后分析结果。ENV-101是一款Hedgehog信号通路小分子抑制剂,通过结合并抑制Hedgehog通路中的关键受体,阻止导致纤维化的肌成纤维细胞异常积聚,从而有望逆转肺纤维化中持续性的创伤修复过程,改善肺部容量与功能。此次公布的数据显示,与安慰剂相比,接受ENV-101治疗12周的特发性肺纤维化(IPF)患者表现出肺血管容积显著减少、肺容量显著增加,并且肺纤维化程度有改善趋势等积极疗效。具体关键分析结果如下:
肺容量显著增加:ENV-101治疗组患者肺容量显著提升(安慰剂组:−113.07 mL;ENV-101组:142.28 mL;p=0.014)。肺纤维化趋势改善:ENV-101治疗组患者肺纤维化程度改善趋势明显(安慰剂组:1.32 pp;ENV-101组:−1.32 pp;p=0.063)。肺血管容积显著减少:ENV-101治疗组患者的标准化肺血管容积显著降低(安慰剂组:0.07 pp;ENV-101组:−0.25 pp;p=0.0007)。

