文章来源:中草药杂志社

尿酸(uric acid,UA)水平过高会增加痛风、肾病及心血管疾病风险[1-3]。高尿酸血症的治疗通常依赖于别嘌呤醇和非布司他等药物,这些药物通过抑制黄嘌呤氧化酶(xanthine oxidase,XO)活性来减少UA生成。然而这些药物可能伴随一些不良反应,别嘌呤醇常导致严重的过敏反应,如皮疹、瘙痒性丘疹、荨麻疹和水疱性反应等;非布司他常导致肝功能异常,如肝功能衰竭和黄疸等[4]。因此,从天然产物中寻找新的替代或补充治疗药物及其前体化合物十分必要。黄酮是一类广泛存在于植物中的多酚类化合物,因其具有多种生物活性而备受关注。其中,黄酮类化合物在降低UA水平方面的潜力近年来引起了大量研究者的兴趣。已有研究表明,一些黄酮类化合物可通过调节UA在肾脏的重吸收或抑制XO的活性发挥降UA作用[5]。已有研究表明艾叶提取物可降低高尿酸血症小鼠UA水平[6],但发挥药效的活性成分未见报道。
本研究通过斑马鱼实验、分子对接和体外酶学实验等探究艾叶醇提物的降UA作用及发挥药效的活性成分,旨在找到其发挥降UA作用的化学成分,为开发不良反应更小的降UA天然药物提供实验依据。
1 材料
1.1 动物
AB品系野生型斑马鱼由国家水生物种资源库国家斑马鱼中心提供,养殖于本实验室循环养殖系统,环境温度28 ℃,养殖用水pH 7.4,昼夜交替周期为14 h/10 h。
1.2 药品与试剂
艾叶购于李时珍医药集团有限公司,经湖北中医药大学陈林霖研究员鉴定为菊科植物艾Artemisia argyi Lévl. et Vant.的干燥叶。金合欢素(批号PS011043,质量分数>98%)、泽兰黄酮(批号PS011078,质量分数>95%)购于成都普思生物科技股份有限公司;槲皮素(批号100081-200907,质量分数98%)购于中国食品药品检定研究院;山柰酚(批号H1817030,质量分数97%)、芹菜素(批号L1927042,质量分数≥98%)、木犀草素(批号L1807023,质量分数≥98%)、氧嗪酸钾(批号K2228489,质量分数≥98.0%)、别嘌醇(批号C2215368,质量分数98%)、黄嘌呤(批号L2107070,质量分数98%)、UA(批号L2215157,质量分数99%)购于上海阿拉丁生化科技股份有限公司;黄嘌呤氧化酶(批号C14951018)购于上海麦克林生化科技有限公司;总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(批号091323240207)、活性氧检测试剂盒(批号080923240115)及脂质氧化丙二醛(malondialdehyde,MDA)检测试剂盒(批号090423231215)购于碧云天生物技术有限公司; XO比色法测试盒(批号WA238VV09710)购于武汉伊莱瑞特生物科技有限公司。
1.3 仪器
Dionex Ultimate 3000型高效液相色谱仪、柱温箱、DAD检测器及变色龙色谱在线分析软件 [赛默飞世尔科技(中国)有限公司];CNW Athena C18-WP色谱柱(上海安谱实验科技股份有限公司);WD-9415B型超声清洗器(北京市六一仪器厂);AB135-S型电子分析天平(瑞士梅特勒托利多仪器公司);PURELAB Ulitra超纯水系统 [威立雅(中国)环境服务有限公司];KZ-II型高速组织研磨仪(武汉塞维尔生物科技有限公司);N60 Implen型紫外分光光度计(北京诺汇诚科技有限公司)。
2 方法
2.1 艾叶醇提物的制备及总黄酮含量测定
2.1.1 艾叶醇提物的制备 艾叶粉碎后过2号筛,取10 g艾叶粉末,加100 mL体积分数80%乙醇回流提取1 h,静置至室温后滤出醇提液,再次加入100 mL体积分数80%乙醇回流提取1 h,滤过后合并滤液,将滤液浓缩至10 mL,即得到质量浓度为1 g/mL的艾叶醇提物。
2.1.2 总黄酮含量测定 参考文献方法[7]使用《中国药典》2020年版铝盐显色法测定艾叶醇提物中总黄酮含量。
2.2 艾叶醇提物对斑马鱼的作用研究
2.2.1 斑马鱼最大耐受浓度(maximum talerated concentration,MTC)的测定 随机选取90尾受精后5 d(5 day post fertilization,5 dpf)的野生型AB品系斑马鱼,将斑马鱼转入24孔板中,15尾/孔。用养鱼用水配制质量浓度分别为250、500、1 000、2 000、4 000 μg/mL(以艾叶生药量计,下同)的艾叶醇提物溶液,除对照组外其余各孔分别加入艾叶醇提物2 mL,对照组加入2 mL养鱼用水,28 ℃处理3 d,根据斑马鱼状态及死亡率确定MTC。
2.2.2 斑马鱼的分组、造模及给药 5 dpf野生型AB品系斑马鱼随机分为对照组、模型组、阳性药(136 μg/mL)组及艾叶低、中、高(250、500、1 000 μg/mL)剂量组。除对照组外,其余各组均使用含250 μmol/L氧嗪酸钾和10 μmol/L黄嘌呤的养鱼水进行造模。阳性药组在养鱼水中给予别嘌呤醇,艾叶低、中、高剂量组分别在养鱼水中给予相应艾叶醇提物,对照组给予等量养鱼用水[8-9]。24 h后收集各组斑马鱼于EP管中,加PBS清洗3遍,吸干PBS后称定质量并将斑马鱼保存于−80 ℃备用。
2.2.3 HPLC检测斑马鱼UA水平 每组取适量斑马鱼并称定质量,加入200 μL PBS后经组织研磨仪匀浆,15 000 r/min、4 ℃离心10 min,取上清,测定UA水平。色谱条件参考文献方法[10]并稍作优化,使用Athena C18-WP色谱柱(250 mm×4.9 mm,5 μm),流动相为pH 2.5乙酸水(A)-5%甲醇(B);0~12 min,5% B;进样体积20 μL;体积流量1 mL/min;柱温30 ℃;检测波长294 nm。采用PBS配制UA质量浓度分别为5、10、15、20、25 μg/mL的系列对照品溶液。在上述色谱条件下进样,以样品质量浓度(p)为横坐标、色谱峰面积(A)为纵坐标绘制标准曲线,得到标准曲线A=1.530 5 p+0.938 9(r=0.999 8)。以样品峰面积计算UA浓度,并计斑马鱼体内UA水平。
斑马鱼体内UA水平=(UA浓度×PBS体积)/(斑马鱼质量)
2.2.4 斑马鱼氧化应激水平的测定 按照“2.2.2”项方法处理斑马鱼,按照试剂盒说明书测定各组斑马鱼MDA、ROS水平及SOD活性。
2.2.5 斑马鱼XO活性的测定 按照“2.2.2”项方法处理斑马鱼,按照试剂盒说明书测定各组斑马鱼体内XO活性。
2.3 艾叶黄酮与XO的分子对接
XO的X-ray晶体三维结构文件来源于RCSB蛋白数据库[11]。该结构包含6个配体,其中FAD和MOS为XO催化黄嘌呤羟基化必要配体[12],保留这些配体并删除其余配体,去掉靶蛋白的水分子并进行加氢、加电荷和计算电荷。通过TCMSP数据库和文献[13]检索收集艾叶中存在的黄酮类成分,用swissADME数据库预测所有化合物的ADME性质,根据Lipinski类药性五原则筛选出33种候选黄酮,在pubchem中下载黄酮类成分结构。选择MO和FAD 2个位点进行分子对接[11]。其中MO中心对接盒子的中心坐标为21.229、13.900、117.409,盒子的大小为40×40×40个网格点,每个网格点大小为0.037 5 nm。FAD中心对接盒子的中心坐标为31.449、53.456、99.022,盒子的大小为40×58×40个网格点,每个网格点大小为0.508 nm。设置参数后运行vina进行半柔性对接。
2.4 艾叶黄酮对XO抑制率的测定
2.4.1 酶促反应体系的建立 反应体系以黄嘌呤为底物,在适宜条件下XO可将黄嘌呤催化为UA,加入各黄酮类成分后反应一定时间,以反应终止时体系中黄嘌呤的浓度计算相应黄酮的XO抑制率。根据预实验确定酶促反应体系中XO终浓度为5 U/L,底物黄嘌呤终浓度为0.40 mmol/L,黄酮类成分浓度分别为0.05、0.10、0.20 mmol/L,反应温度为37 ℃,反应时间为60 min。
2.4.2 色谱条件及标准曲线的建立 参考文献方法[14]稍作优化,使用Athena C18-WP色谱柱(250 mm×4.9 mm,5 μm);流动相为0.02 mol/L磷酸二氢钾溶液(A)-5%甲醇(B);0~18 min,5% B;进样体积20 μL;体积流量1 mL/min;柱温30 ℃;检测波长254 nm。采用PBS配制黄嘌呤浓度分别为0.1、0.2、0.4、0.6、0.8 mmol/L的系列对照品溶液。在上述色谱条件下进样,以p为横坐标、A为纵坐标绘制标准曲线,得到的标准曲线为A=167.42 p+0.452 6(r=0.999 8)。
2.4.3 艾叶黄酮对XO抑制率的测定 取100 μL 50 U/L的XO溶液于24孔板中,各给药组分别加入50、100、200 μL的别嘌呤醇、木犀草素、金合欢素、槲皮素、山柰酚、泽兰黄酮和芹菜素(1 mmol/L)的对照品溶液,对照组加入等体积PBS,37 ℃孵育15 min。加入400 μL的黄嘌呤溶液(1 mmol/L)启动反应,37 ℃孵育60 min后,加入500 μL HCl(1 mol/L)终止反应。将反应溶液定容至2 mL,进样检测黄嘌呤浓度,计算XO抑制率。
2.5 统计学分析
利用GraphPad prism 10.0软件进行统计学分析,数据以表示,组间比较采用单因素方差分析。
3 结果
3.1 艾叶醇提物总黄酮含量测定
艾叶醇提物中总黄酮质量浓度为18.4 mg/mL。
3.2 艾叶醇提物对斑马鱼的作用研究
3.2.1 斑马鱼的MTC 斑马鱼经250、500、1 000、2 000、4 000 μg/mL艾叶醇提物药浴处理3 d后,艾叶醇提物各剂量组死亡率依次为0、0、0、53.3%和93.3%。因此,斑马鱼的MTC为1 000 μg/mL,选择250、500、1 000 μg/mL剂量作为低、中、高剂量。
3.2.2 对斑马鱼UA水平的影响 如图1所示,与对照组比较,模型组UA水平显著升高(P<0.05);与模型组比较,阳性药组及艾叶醇提物中、高剂量组UA水平显著降低(P<0.05、0.01),提示艾叶醇提物能显著降低高尿酸血症斑马鱼体内的UA水平。

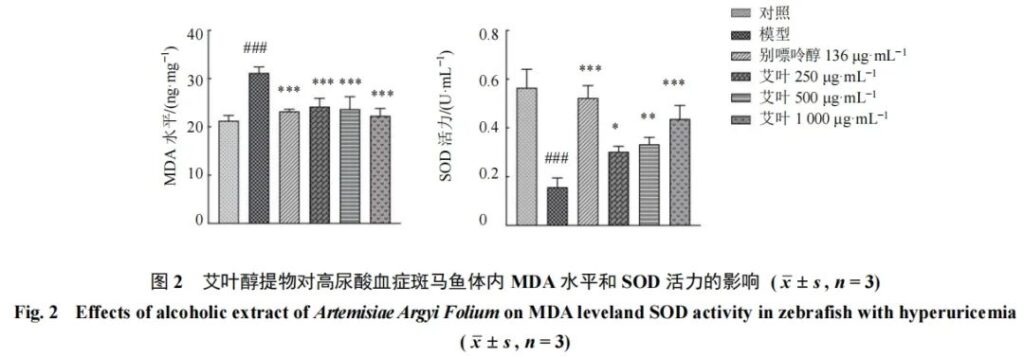
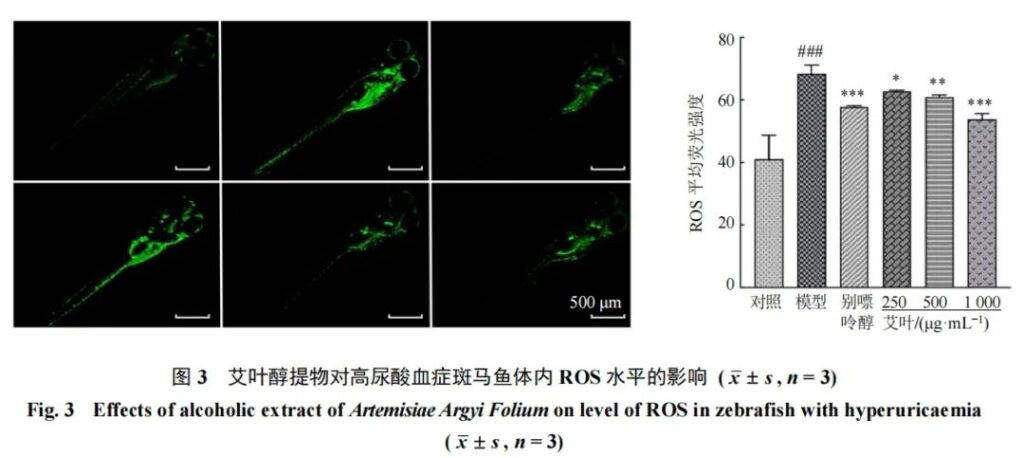
3.2.3 斑马鱼氧化应激水平的测定 如图2所示,与对照组比较,模型组斑马鱼MDA水平显著升高(P<0.001),SOD活力显著降低(P<0.001);与模型组比较,艾叶醇提物低、中、高剂量组MDA水平显著降低(P<0.001),SOD活力显著升高(P<0.05、0.01、0.001)。如图3所示,与对照组比较,模型组斑马鱼ROS水平显著升高(P<0.001);与模型组比较,艾叶醇提物低、中、高剂量组ROS水平显著降低(P<0.05、0.01、0.001)。结果表明,艾叶醇提物能够促进高尿酸血症斑马鱼的氧化还原平衡,改善斑马鱼机体的氧化应激状态。其原因可能是模型组斑马鱼由于UA水平升高而使氧化应激反应加剧[15],经艾叶醇提物处理后,斑马鱼UA水平降低,从而改善了氧化应激状态。
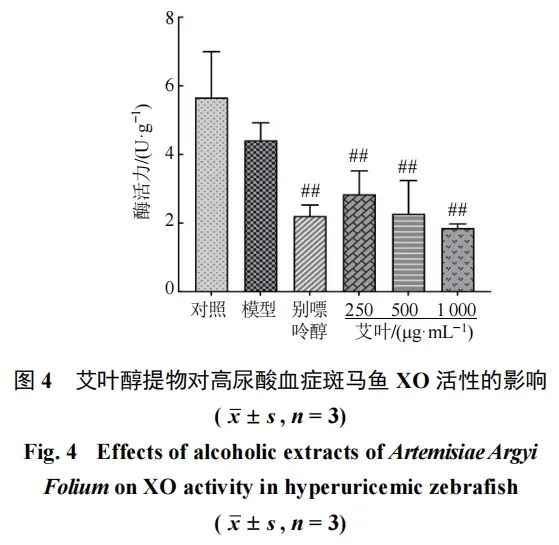
3.2.4 斑马鱼XO活性的测定 如图4所示,与对照组比较,艾叶低、中、高剂量组斑马鱼XO活性均显著降低(P<0.01),推测艾叶醇提物可能通过抑制斑马鱼XO活性,从而抑制UA的生成。
3.3 分子对接
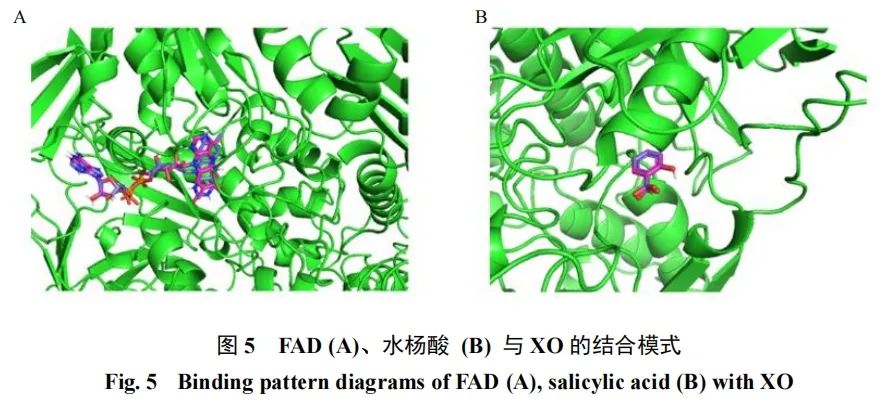
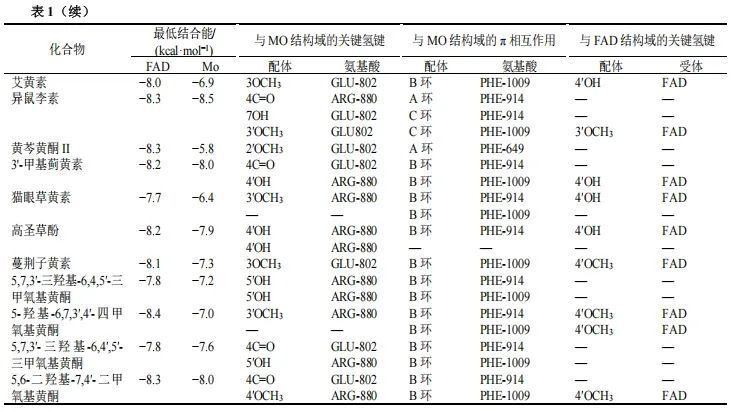
3.3.1 准确性验证 使用pymol软件将XO中的原始配体FAD提取出来,根据“2.3”项下方法将FAD与去除FAD的XO进行分子对接,结果见图5。用pymol计算对接后的配体分子与原配体分子的均方根偏差(root mean square deviation,RMSD)=0.845。用同样方法将水杨酸与XO的MO中心进行对接,对接后的配体分子与原配体分子的RMSD=0.000,表明该方法参数设置合理,程序适用,可用于后续黄酮类化合物的分子对接。
3.3.2 艾叶黄酮与XO的分子对接 艾叶黄酮与XO的FAD和MO中心对接的最低结合能、关键氢键和π-π相互作用见表1。在XO的MO中心,ARG-880、GLU-802、PHE-914和PHE-1009是XO催化黄嘌呤生成UA过程中的关键氨基酸。艾叶黄酮化学成分,如木犀草素、槲皮素、山柰酚、泽兰黄酮、棕矢车菊素、异泽兰黄素、茵陈色原酮、高车前素、6-甲基苜蓿素和芹菜素等均能与这些关键氨基酸结合,这说明以上化学成分可能竞争黄嘌呤与XO的结合位点来抑制XO的催化反应。FAD主要负责黄嘌呤羟基化反应的电子转移,分子对接研究发现牡荆素、圣草酚、木犀草素、6-甲基苜蓿素、棕矢车菊素、异泽兰黄素、矢车菊黄素和蔓荆子黄素等黄酮能与FAD形成氢键,因此推测以上化学成分可能通过抑制UA生成反应的电子转移过程来抑制UA生成。
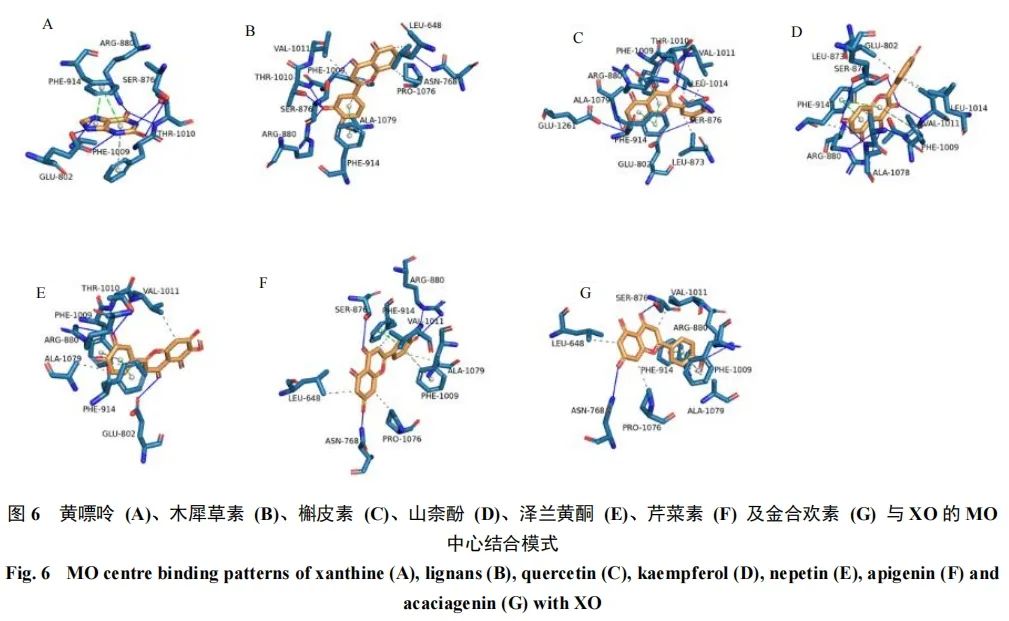
根据结合能大小筛选出低于所有黄酮结合能均值的黄酮,再根据与关键氨基酸形成相互作用力的数量筛选出可能具有较强XO抑制活性的化合物。木犀草素、槲皮素、山柰酚、泽兰黄酮、芹菜素和金合欢素在MO中心和FAD中心的结合能均低于其他化学成分,且能与XO形成至少3个及以上的关键作用力。推测木犀草素、槲皮素、山柰酚、泽兰黄酮、芹菜素和金合欢素具有较好的抑制XO活性,各化学成分与XO的MO中心结合模式见图6。
3.4 艾叶黄酮对XO抑制率的测定
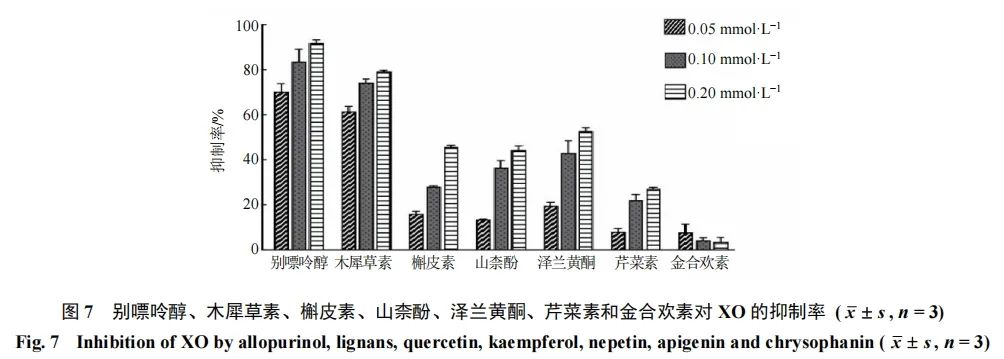
如图7所示,在相同浓度下木犀草素与阳性药别嘌呤醇具有相近的XO抑制率,而槲皮素、山柰酚、泽兰黄酮、芹菜素也具有抑制XO活性,且抑制作用呈浓度相关性。该实验结果提示艾叶黄酮降UA作用的机制可能与抑制XO活性相关,而主要发挥XO抑制活性的黄酮类化学成分可能为木犀草素、槲皮素、山柰酚、泽兰黄酮及芹菜素,而金合欢素对XO的抑制率较低且不呈剂量相关,其原因有待进一步探讨。

4 讨论
本研究表明UA水平升高可能破坏氧化还原平衡,加剧氧化应激反应。艾叶醇提物可以降低UA生成,同时改善机体氧化应激状态,该结果与研究报道结果一致[6]。本研究在明确药效的基础上,开展了艾叶醇提物降UA的机制研究。通过测定各组斑马鱼XO活性发现艾叶醇提物可能通过抑制XO活性达到降UA作用。研究发现,多种植物中的黄酮类化合物均有抑制XO活性的作用[5],因此,利用分子对接技术模拟了艾叶中各黄酮与XO的结合情况。分子对接结果解释了艾叶醇提物发挥降UA作用的机制。XO中有2个 [2Fe-2S] 簇中心、1个FAD中心和1个MO中心,其中MO中心负责与黄嘌呤结合并发生羟基化反应,[2Fe-2S] 簇中心和FAD中心负责反应后的电子转移。在MO中心,ARG-880和GLU-802能够稳定反应中间体;PHE-914和PHE-1009形成夹心状占据底物黄嘌呤的芳香环,并通过强烈的π-π堆积作用稳定黄嘌呤,其对黄嘌呤与XO的识别有关键作用[16-18]。FAD主要负责黄嘌呤羟基化反应后的电子转移,黄嘌呤在MO中心被转化为UA后将产生1个电子,该电子经 [2Fe-2S] 转移至FAD中心,并经FAD转移至超氧阴离子及过氧化氢中,若黄酮占据FAD中心,则可能影响黄嘌呤羟基化反应后的电子转移及超氧阴离子和过氧化氢的生成,进而阻断UA的生成反应[19]。根据各黄酮在XO的MO和FAD 2个关键活性位点的结合能及与关键氨基酸形成作用力的数量,从33种黄酮中筛选出可能具有较高抑制活性的黄酮,并通过体外实验了进一步验证了分子对接的结论。结果发现,木犀草素、槲皮素、山柰酚、泽兰黄酮、芹菜素均能抑制XO的活性,且具有剂量相关性。其中,木犀草素的抑制率接近同等浓度的别嘌呤醇,这与研究报道结果相似[20]。
综上,本研究通过动物实验证明了艾叶醇提物具有降UA作用,通过分子对接及XO抑制率实验发现发挥降UA作用的主要成分为黄酮类化合物。分子对接研究发现艾叶中黄酮类化合物可能通过竞争黄嘌呤结合位点或影响反应的电子转移过程而抑制XO活性,进而影响UA的生物合成。通过体外酶学实验研究发现木犀草素、槲皮素、山柰酚、泽兰黄酮、芹菜素在一定浓度下均能抑制XO活性,推断其可能为发挥降UA作用的关键化学成分。本研究系统阐述了艾叶醇提物的降UA作用、机制及物质基础,为研发降UA药物提供实验依据。
利益冲突 所有作者均声明不存在利益冲突
